巨細胞病毒疫苗的發展
人類巨細胞病毒(human cytomegalovirus, HCMV)引發的機會性感染及先天性感染仍是全球性的人類健康重大威脅,特別是對於免疫力較弱的嬰幼兒、老年人及病人。基於HCMV獨特生活史及潛伏的特性,有時疾病治療的效果並不顯著,因此有效的疫苗是迫切需要,其中對育齡婦女而言,孕婦的HCMV垂直感染與胎兒會導致流產或新生兒殘疾。HCMV疫苗的開發除了可避免健康人受到病毒的感染外,並有助於預防先天性感染及很多的新生兒的殘疾。
文/陳淵銓
●人類巨細胞病毒的認識
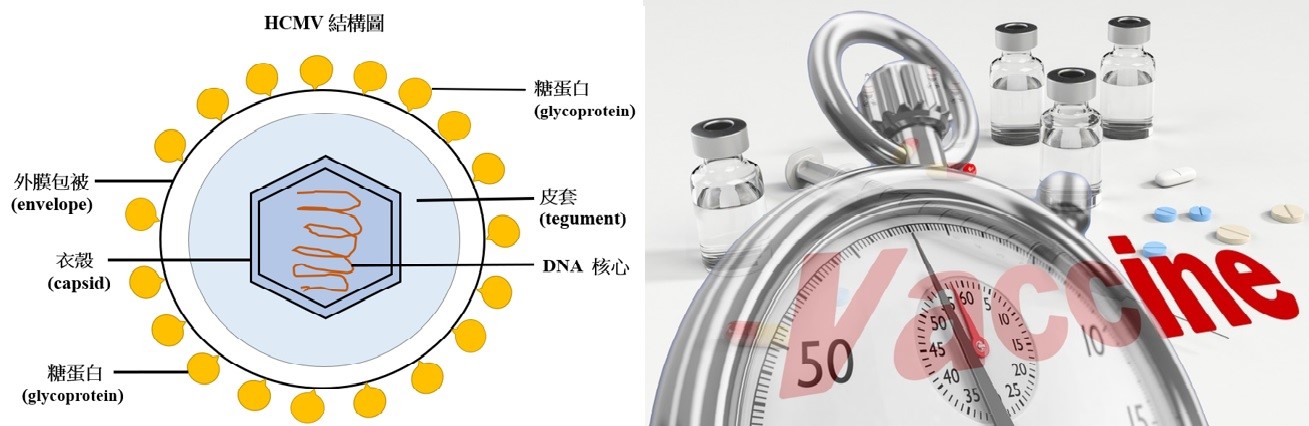
HCMV屬於皰疹病毒科的一個屬,基因組是大小約230 kb的雙鏈DNA,病毒顆粒(virion)直徑約為180 nm。HCMV的結構由內到外分別是DNA核心(core)、衣殼(capsid)、皮套(tugument)和外膜包被(envelope)。DNA基因組被由162個capsomere組成的衣殼所包裹,皮套被構造是脂質雙層(lipid biolayer)的外膜包被包圍,外膜包被含有20多種參與對宿主細胞的附著和穿透的糖蛋白(glycoprotein)。與所有皰疹病毒一樣,HCMV基因按以下順序進行表達:(1)立即早期基因(immediately early gene):編碼調節蛋白(regulatory protein)(2)早期基因(early gene):編碼用於複製病毒DNA的酵素(3)晚期基因(late gene):編碼用於裝配感染性病毒顆粒的結構蛋白(structural protein)。
●HCMV感染引起疾病
HCMV主要透過血液、唾液、精液、尿液、乳汁及垂直感染來傳播,感染的主要標的細胞是單核細胞(monocyte)、淋巴細胞(lymphocyte)及上皮細胞(epithelial cell),主要的潛伏部位在外圍單核細胞(peripheral monocyte)及CD34 +前驅細胞(progenitor cell)。在健康成年人體內,HCMV因為受到免疫系統的控制,通常不會引起任何症狀或僅能造成輕度疾病。然而,HCMV感染後有能力長期在體內潛伏(latency),並在個體的免疫功能不成熟(如嬰幼兒)或免疫系統老化、損傷、受抑制(如老年人、病人、後天免疫缺乏症候群患者及器官移植者等)時復發,潛伏的HCMV重新活化(reactivation)會破壞患者的組織而導致器官疾病,並可能觸發免疫調節作用,此種潛伏性感染(latent infection)形成的機會性感染(opportunistic infection)可引發多種疾病,如肺炎,視網膜炎,胃腸道疾病,心智遲緩及心血管疾病等,嚴重時甚至會造成死亡。此外,經由懷孕婦女傳染給胎兒的先天性感染(congenital infection)是HCMV的主要問題,全球罹患率估計約為0.64%,其中17-20%被感染的嬰兒將遭受各種程度的殘疾,包括聽力損失、視力障礙、精神運動功能障礙及學習障礙等。
●預防疫苗的研發
HCMV的感染可能造成人類嚴重疾病,而且初估帶原者人數很多,傳播範圍也相當廣泛,基於疾病的預防重於治療,疫苗的開發有其必要性,但HCMV的疫苗必須具有特異性強的體液免疫反應(humoral immunity),並引發細胞介導的免疫反應(cell-mediated immunity),才能提供完整保護。多年來,儘管有持續不斷的疫苗研發工作,但尚無批准用於預防HCMV感染的疫苗上市,可能是由於對其感染防護所需的免疫反應仍未十分明瞭。然而,近年已有以下研發成果,為HCMV疫苗的上市開啟一線曙光:
在2019年,美國研究人員使用天竺鼠做為動物模式開發CMV疫苗。與HCMV一樣,天竺鼠巨細胞病毒(guinea pig cytomegalovirus, GPCMV)也需要天竺鼠的特異性細胞受體-血小板源性生長因子受體α(platelet-derived growth factor receptor α)才能進入成纖維細胞(fibroblast cell),但要進入非成纖維細胞(non-fibroblast cell)則需要其他受體,而已知GPCMV編碼的五聚體複合物(pentamer complex)(一種位於外膜包被上的糖蛋白)是使病毒進入天竺鼠的非成纖維細胞的關鍵因子。他們使用失去功能的單循環傳染性(disabled infectious single-cycle)GPCMV疫苗株接種到天竺鼠,誘導宿主產生針對病毒五聚體複合物的體液免疫反應,以增強非成纖維細胞的中和作用,因而保護天竺鼠免受到GPCMV的感染。此動物實驗結果發現,利用五聚體複合物作為疫苗一部分的設計可以顯著提高疫苗的功效,證明針對五聚體複合物的免疫反應在對抗先天性CMV感染的重要性。
在2019年,美國研究人員在人體試驗中,使用缺乏在活體內複製能力的缺陷病毒V160作為候選疫苗,結果顯示在HCMV血清陰性的人體中是安全的且具免疫原性(immunogenicity),並可誘導宿主產生體液免疫反應及細胞介導的免疫反應,而且反應強大、持久且具有長期記憶性。他們更進一步證明來自V160免疫接種的HCMV血清陰性受試者的血清與來自血清陽性受試者有相似的屬性,包括針對HCMV抗原的高親和力抗體,因妊娠前血清反應陽性的婦女所生的孩子受先天性HCMV感染的可能性較小,故可誘導血清反應陰性的婦女產生類似血清反應陽性的婦女的免疫反應的疫苗可能是有效的。本研究結果顯示,V160雖然是複製缺陷型病毒,但誘導的抗體可中和一組遺傳上不同的臨床分離株,可以在細胞培養中防止病毒感染幾種不同類型的人類細胞,並可在人體中有效地誘導類似於HCMV血清反應陽性患者的抗體產生,是一種能保護血清反應陰性的育齡婦女免受HCMV感染的潛在候選疫苗,但仍需在臨床上評估其預防先天性感染的效能(efficacy),以確保疫苗的安全性和有效性。
參考資料:
- Krishna BA, Wills MR, Sinclair JH. Advances in the treatment of cytomegalovirus. Br. Med. Bull. 2019, Sep 19;131(1):5-17. doi: 10.1093/bmb/ldz031.
- Choi KY, El-Hamdi NS, McGregor A. Inclusion of the viral pentamer complex in a vaccine design greatly improves protection against congenital cytomegalovirus in the guinea pig model. J Virol. 2019 Oct 29;93(22). pii: e01442–e014519. doi: 10.1128/JVI.01442-19. Print 2019 Nov 15.
- Liu Y, Freed DC, Li L, Tang A, Li F, Murray, EM, Adler SP, McVoy MA, Rupp RE, Barrett D, Ye X, Zhang N, Beck K, Culp T, Das R, Song L, Vora K, Zhu H, Wang D, Espeseth AS, An Z, Musey L, Fu TM,. A replication defective human cytomegalovirus vaccine elicits humoral immune responses analogous to those with natural infection. J. Virol. 2019 Nov 13;93(23). pii: e00747-19. doi: 10.1128/JVI.00747-19. Print 2019 Dec 1.
- Chen SJ, Wang SC, Chen YC. Antiviral agents as therapeutic strategies against cytomegalovirus
Viruses. 2019 Dec 23;12(1). pii: E21. doi: 10.3390/v12010021. Review.
