從突破到技術:iPS細胞是如何製造的?
iPS 細胞的製備核心在於「重新編程」,透過山中因子(Oct4、Sox2、Klf4、c-Myc)重啟幹細胞基因網絡,使體細胞恢復多能性。隨著技術演進,基因導入方式從高風險的逆轉錄病毒,逐漸轉向仙臺病毒、質體、mRNA 甚至小分子化合物,安全性與臨床潛力不斷提升。然而,低效率、品質差異、培養依賴異源成分及規模化生產等挑戰,仍是推動 iPS 技術走向臨床的關鍵課題。未來透過轉錄因子優化、小分子輔助、無血清培養及自動化平臺,iPS 技術有望成為再生醫學與藥物開發的核心工具。
撰文|林泳亨
在上一篇中,我們回顧了iPS細胞的誕生歷程。這項研究不僅顛覆了「細胞命運不可逆」的傳統觀點,也為再生醫學提供了全新的可能性。然而,一項劃時代的發現,往往只是開端。要讓iPSC技術真正應用於疾病研究、藥物開發或臨床治療,關鍵在於如何將這項技術從實驗室的「突破」,技轉為穩定、安全且具可擴展性的「平臺」。本篇將從分子機制到實際操作介紹目前主流的iPS細胞製備技術,並探討技術演進背後的挑戰。
重啟基因網絡:iPS細胞製備的關鍵因子
iPS細胞的製備核心在於「重新編程」(reprogramming),也就是將體細胞誘導回到多功能狀態的幹細胞。這一過程依賴特定轉錄因子的導入,以啟動幹細胞相關基因的表現,抑制體細胞基因,進而改變細胞命運。
山中伸彌在2006年確立了四個關鍵轉錄因子:Oct4、Sox2、Klf4和c-Myc。這些因子各自具備不同的功能:Oct4與Sox2能活化幹細胞特異性基因並抑制分化路徑,是幹細胞狀態的核心調控因子。Klf4則協助細胞在重新編程過程中維持穩定狀態,避免凋亡,並促進細胞週期進行。c-Myc能加速細胞增殖並促進染色質鬆弛,提高重新編程效率;然而c-Myc本身為一種致癌基因,因此在臨床應用中受到限制。而在京都大學iPS細胞研究所於2021年的研究中發現可以利用MYCL基因替代c-Myc。研究發現透過MYCL轉染形成的iPSC細胞增殖率較小,除了降低致癌的可能性,同時也提升了重新編程的效率。透過這些因子的共同作用,協同調整轉錄網絡與表觀遺傳標記,使體細胞逐步喪失原有特性,並啟動幹細胞基因表現,最終轉化為iPS細胞。
重新編程的過程大致可分為兩個階段。在起始階段,轉錄因子開始干擾原有基因表達,體細胞基因逐步被抑制,而與多功能性相關的基因則逐漸啟動,此時細胞進入一個不穩定的中間狀態,呈現出部分幹細胞特徵。若細胞順利通過此階段,便會進入穩定階段,在這一階段中,核心幹細胞基因的表現被全面激活,並伴隨 DNA 去甲基化、組蛋白修飾變化等表觀遺傳重塑,細胞在功能與分子標記上逐步趨近於胚胎幹細胞。由於這一過程的效率普遍偏低(往往低於0.1%),且需時數週至數月,因此如何提升效率與穩定性成為後續技術改良的關鍵。近期 ChatGPT 的原生公司 OpenAI 與 Retro Biosciences 合作,利用一款專門設計的小型 AI 模型 GPT-4b micro,在蛋白質工程上成功設計出新的山中因子變體。實驗顯示,這些變體能讓細胞重編程效率提升超過 50 倍,並增強 DNA 損傷修復能力,所產生的 iPSC 也具備多能性與基因組穩定性。
從病毒到小分子:重新編程技術的演進
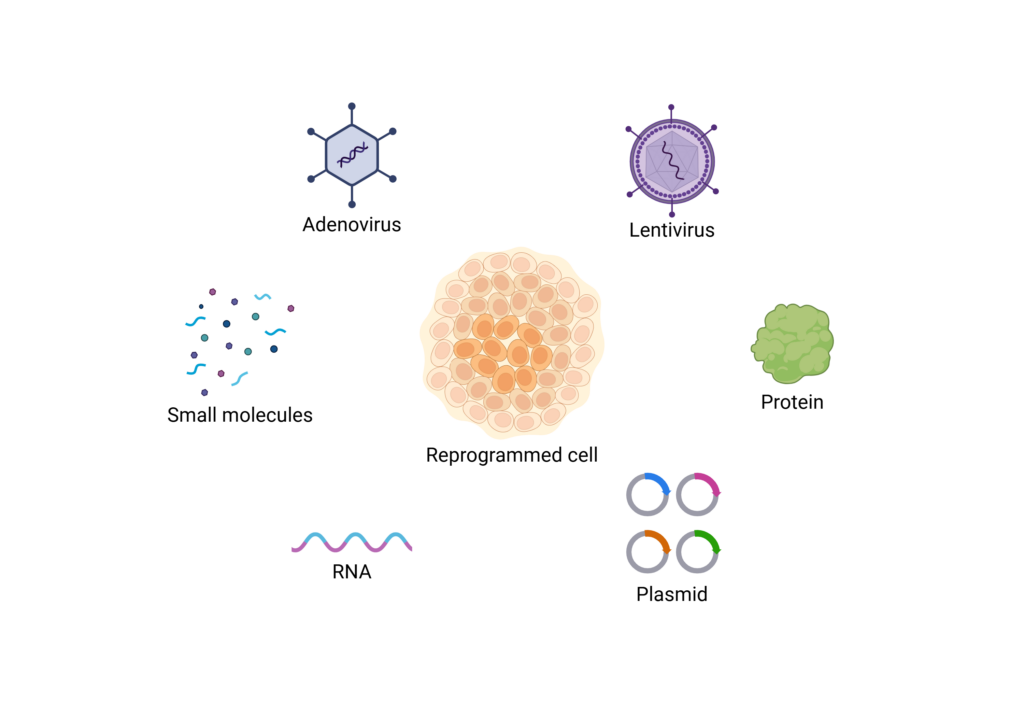
在了解轉錄因子如何誘導體細胞產生 iPS 細胞之後,下一個要思考的問題便是:如何將這些轉錄因子導入細胞。早期的 iPS 細胞製備多依賴病毒載體來輸入轉錄因子,雖然效率高,但因涉及基因整合而存在潛在致癌風險,因此推動科學家積極尋找更安全的替代方案。最初使用的逆轉錄病毒能有效地將基因整合至細胞基因組,確保重編程因子的長期表達,但由於整合位置隨機,可能引發插入突變或癌基因活化。後續的慢病毒系統雖仍具有整合風險,但相對較低,並可設計為可移除式系統,以提升安全性。為了進一步降低風險,研究者又開發了仙臺病毒系統。仙臺病毒是一種不整合入基因組的 RNA 病毒,轉錄因子僅存在於細胞質中,隨著重編程完成會自然消失,因此被視為目前最具臨床應用潛力的病毒選項。
除了病毒載體之外,非病毒載體技術逐漸受到青睞。其中,附加型質體是一種不會整合入基因組的環狀DNA,能在細胞中短暫存在,重新編程完成後自然被稀釋或分解。這類質體因安全性高而廣泛應用於臨床等級的 iPS 細胞製備。另有轉座子系統,雖然會短暫整合基因至染色體中,但可透過酶移除,大幅降低長期風險。此外,mRNA 導入法則以瞬時表達方式實現重新編程,不僅完全不涉及基因組修改,且能藉由重複施打達到所需表現量,是一種高度安全但操作上較繁瑣的方法。
除了基因導入方法外,近期的研究則聚焦於小分子化合物誘導的「化學重新編程」。科學家發現,透過調控細胞內訊號傳導路徑、表觀遺傳酶活性及細胞代謝狀態,部分小分子組合可取代轉錄因子的功能,實現完全不涉及基因改造的 iPSC 製備。這類方法的最大優勢在於安全性高、操作簡便、成本低廉,且有望發展成標準化製程。然而目前在製造效率上仍受到限制,對劑量與時機的控制要求極高,以及是否與利用轉錄因子編成的 iPS 細胞有所異同仍待考證。
優化重新編程平臺的關鍵挑戰
儘管iPS技術已取得長足進展,但要真正進入臨床與產業應用,仍需解決若干核心挑戰。首先是重新編程效率與速度的提升。目前研究聚焦於發掘更有效的轉錄因子組合、添加促進重新編程的小分子以及優化培養條件,以縮短製程時間並提升成功率。其次是品質控制,並非所有iPS細胞都具備等同的分化潛能與基因穩定性,有些可能保留原始體細胞的表觀記憶,或在長期培養中產生突變,因此必須建立一套嚴謹的檢測系統,評估其多功能性、基因組完整性與表觀遺傳狀態。
此外,傳統幹細胞培養往往依賴動物血清或滋養層細胞,這些異源成分帶來免疫風險與不可預測性。開發無血清、成分明確且可自我維持的培養系統,將有助於確保製程標準化與臨床應用安全。隨著臨床需求日增,如何進行 iPSC 的規模化生產也成為當前重要議題。利用自動化設備與生物反應器建立標準化流程,不僅能大幅提升產能,也能確保產品的一致性與可追溯性。特別的是,臺灣在自動化生產領域具有優勢,若能將 iPS 細胞製作與自動化生產結合,將有望達到高效率的大規模製備,成為臺灣在此領域的重要競爭力,為 iPSC 的廣泛應用奠定基礎。
從實驗室到臨床應用的關鍵一哩路
iPSC 技術的發展,從早期的概念性突破,逐漸轉化為一門高度工程化的細胞製造流程。從病毒載體到化學重新編程,每一步技術的演進都反映出對效率、安全與臨床應用的高度重視。而在下一篇中,我們將進一步探討:這些被逆轉命運的細胞,究竟如何被應用於疾病研究、藥物開發以及細胞療法?
