【2016諾貝爾生理醫學獎】發現自噬作用機制

編譯|國立臺灣大學生命科學系 范姜文榮
2016年諾貝爾生理醫學獎桂冠,頒給發現自噬作用機制的日本細胞生物學家大隅良典教授。巨自噬作用 (Macroautophagy) 後來稱作自噬作用 (autophagy),是演化保留下來的作用之一,因此真核生物能透過雙層膜的囊泡 (vesicle),將所隔離的部分細胞質成分,運送至溶體 (lysosome) 進行消化,以便再利用。自噬作用與其它分解機制不同,它能移除存活時間長的蛋白質、巨分子複合體、以及已退化或受損的胞器。自噬作用調控飢餓狀態下細胞內非重要成分的消化及再利用,以及參與移除細胞某些成分以提供空間給新成分的各種生理過程。此外,自噬作用是清除入侵微生物及毒性蛋白質聚合物的重要細胞機制,因此在感染、老化、及人類疾病的發病機制上,扮演重要的角色。
雖1960年代已觀察到自噬作用,但仍長達數十年不甚了解其機制及生理相關性。大隅教授的研究,顯著改變我們對此重要細胞機制的理解。1993年,大隅教授發表酵母菌自噬作用的15個關鍵基因,經一系列精巧的後續實驗,他選殖(clone)酵母菌及哺乳動物細胞的許多關鍵基因,並闡明這些基因所編碼蛋白質的功能。以大隅教授的開創性發現為基礎,自噬作用已在人類生理及疾病機制上受到高度重視。
●自噬作用的奧秘
1950年代初期,Christian de Duve對胰島素的作用有興趣,所以使用Albert Claude研發的細胞分離法,來研究葡萄糖-6-磷酸酶 (glucose-6-phosphatase) 在細胞內的作用位置。在控制組實驗中,他也追蹤到酸性磷酸酶 (acid phosphatase) 的分佈,但在新鮮的分離肝臟碎片中無法偵測到任何酵素活性。引人注目地,假如這些肝臟碎片保存在冰箱5天,又再度出現酵素活性。後來瞭解這是因為蛋白酶 (proteolytic enzymes) 被隔離在由de Duve命名的溶體 (lysosome) 中,它是過去未知的膜狀構造。透過電子顯微鏡觀察富含溶體的肝臟碎片及肝臟切片,確認溶體是細胞內的一種獨特胞器。Christian de Duve、Albert Claude,以及George Palade,三人因發現溶體的構造與功能,共同榮獲1974年諾貝爾生理醫學獎桂冠。
發現溶體後不久,研究人員在小鼠腎臟正常發育期間,發現部分細胞質成分被隔離至膜狀構造;而含有少量細胞質及粒線體的類似膜狀構造,也出現在有水腎症狀 (hydronephrosis) 的大鼠腎臟近端小管細胞 (proximal tubule cells) 中。在細胞退化早期,這種囊泡會和具有酸性磷酸酶的顆粒結合 (colocalize),且此構造數量會隨著退化的進展而增加。含退化性細胞質的膜狀構造也出現在正常大鼠肝細胞中,且當灌注升糖素 (glucagon perfusion)或暴露於有毒物質時,該構造的密度會大量增加。
瞭解溶體能消化細胞內部成分後,1963年Christian de Duve創造一新專有名詞「自噬作用 (autophagy)」,數年後在一篇回顧論文中廣泛討論這個概念。當時,令人矚目的是以電子顯微鏡觀察到哺乳動物細胞的自噬作用。已知自噬作用會微量出現(low basal level),當各種組織進行分化或重整,包括大腦、腸道、腎臟、肺臟、肝臟、前列腺、皮膚、以及甲狀腺,會增加自噬作用的發生。推測自噬作用可能是應付飢餓代謝壓力的機制,且可能對疾病發病機制,扮演重要角色。因此,自噬作用廣泛出現在各物種,如單細胞真核生物、多細胞動物如變形蟲、眼蟲 (Euglena gracilis)、眼原蟲 (Tetrahymena)、昆蟲、以及青蛙,顯示自噬作用為一歷經演化保存下來的功能。
接下來數十年,該領域的進展很有限。有研究指出營養物質與激素會影響自噬作用,在哺乳動物組織,胺基酸耗損會誘發自噬作用,胰島素刺激會抑制自噬作用。另外,也有研究指出小分子3-甲基腺嘌呤 (3-methyladenine) 會抑制自噬作用。一篇結合細胞分離法 (cell fractionation)、自動放射照像術 (autoradiography),及電子顯微鏡的研究指出,自噬作用初期會出現雙層膜構造-吞噬泡 (phagophore),然後向外延伸包覆部分細胞質,最後封閉成為缺乏水解酵素的囊泡 (vesicle) -自噬小體 (autophagosome)(圖1)。
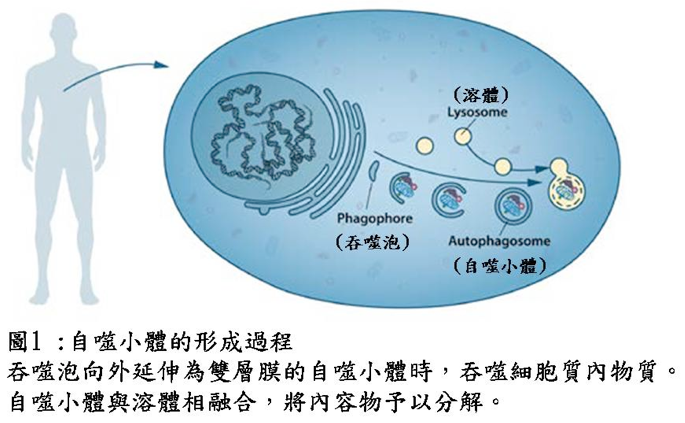
儘管許多證據顯示自噬可能是重要的細胞作用,但其機制及調控仍不明。當時只有少數幾個實驗室在研究此主題,主要是使用相關的或描述性的方法,聚焦於自噬作用晚期,也就是與溶體結合前後的步驟。現在我們已知自噬小體的存在短暫,且與溶體結合前僅存在約10~20分鐘,使得其型態及生化研究都非常困難。
在de Duve提出「自噬作用」專有名詞後將近30年,1990年代初期,自噬過程仍然是生物學上難以理解的問題。無法成功使用分子標記,且自噬作用機制的構成要素難以證實,許多基本的問題仍無法回答,例如自噬過程如何被誘發?自噬小體如何形成?自噬作用對細胞或個體存活有何重要性?自噬作用對人類疾病是否扮演重要角色?
●發現自噬作用的機制
1990年代初期,當時是日本東京大學助理教授的大隅良典,決定使用出芽生殖的酵母菌Saccharomyces cerevisae作為模式生物,他所提出的第一個問題為自噬作用是否存在單細胞個體。酵母菌液泡的功能相當於哺乳動物的溶體(lysosome)。大隅教授推論,若酵母菌存在自噬作用,當抑制液泡內酵素,將會造成吞噬入液泡的細胞質成分累積。為驗證該假說,他製作出缺少液泡蛋白酶如蛋白酶A、蛋白酶B、及羧基肽酶(carboxy-peptidase)的酵母菌品系。他發現在無營養的培養皿生長的基改酵母菌,使用光學顯微鏡就能觀察到自噬顆粒(autophagic bodies)會累積在不正常液泡內,此特殊型態,使他確信能找到控制誘發自噬作用的基因。藉由誘發酵母菌細胞缺損液泡蛋白酶的隨機突變,大隅教授發現第一個突變酵母菌無法在液泡累積自噬顆粒;他命名此基因為「autophagy 1 (APG1)」。他後來也發現,在氮源缺乏的培養基中,APG1突變酵母菌比野生型酵母菌較快失去存活能力。第2道篩選則使用較為便利的表現型及額外特徵,去辨識75個隱性突變,將它們分類成不同的互補群(complementation group)。1993年大隅教授發表在期刊FEBS論文指出,真核生物有高達15個基因對自噬作用的活化扮演重要角色;他將這些基因命名為APG1-15。因為新的自噬作用基因已確認存在於酵母菌及其它物種,所以統一的基因命名系統採用ATG簡寫來表示,本篇內文之後使用此命名。
在接下來的數年,大隅教授選殖數個ATG基因及闡明這些基因編碼蛋白質產物的功能。ATG1基因選殖顯示,該基因編碼「絲胺酸/蘇胺酸激酶(serine/threonine kinase)」,證實在自噬作用扮演蛋白質磷酸化的角色;其它研究也顯示蛋白質Atg1會與ATG13基因的蛋白質產物形成複合體,且受TOR激酶的調控。TOR在養分充足的細胞中會活化,且能高度磷酸化蛋白質Atg13以避免形成Atg13:Atg1複合體。相反地,當TOR因細胞飢餓而失去活性時,去磷酸化的蛋白質Atg13會與Atg1結合,活化自噬作用;接著,出現五角形複合體的活化激酶,包括Atg1、Atg13、Atg17、Atg29、及Atg31。該複合體的集合物是形成「自噬小體」階梯式反應(cascade of events)的第1步驟。
自噬小體的形成,與膜主體蛋白Atg9、以及磷脂酸肌醇-3激酶 (phosphatidylinositol-3 kinase;PI3K)複合體有關聯,PI3K由液泡蛋白所組成,即液泡排列有關的蛋白質34(Vps34)、Vps15、Atg6、及Atg14。該複合體產生「磷脂酸肌醇-3磷酸鹽(phosphatidylinositol-3-Phosphate)」及另外的Atg蛋白質被補充至吞噬泡(phagophore)的膜構造。吞噬泡藉由2個「類泛素蛋白接合階層(ubiquitin-like protein conjugation cascades)」,向外擴展形成一成熟的自噬小體(autophagosome) (圖2)。
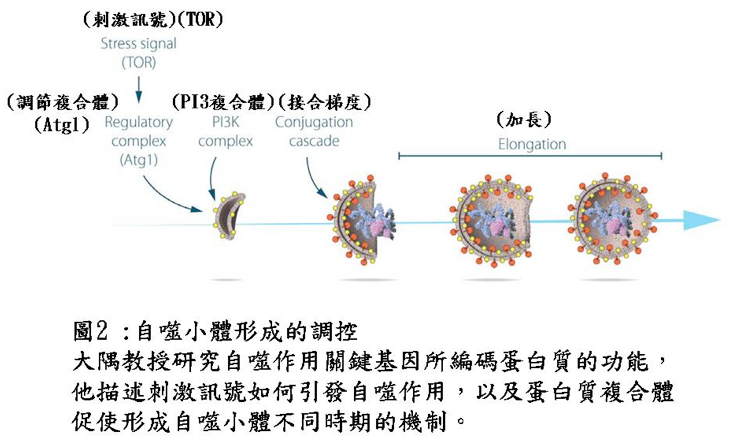
蛋白質Atg 8作用位置的研究顯示,成長中酵母菌細胞的Atg 8在細胞質平均分佈,但在飢餓酵母菌細胞,Atg 8 形成較大聚合物,並能結和在自噬小體及自噬顆粒上。大隅教授提出驚人的發現,Atg 8能否聚集在膜上決定於2個「類泛素接合系統 (ubiquitin-like conjugation systems)」,該系統能促進Atg 8共價鍵結合至膜脂質「磷脂醯乙醇胺 (phosphatidylethanolamine)」,這2個系統具有相同的活化酶Atg 7;第一次結合時,Atg12藉與Atg7的「半胱胺酸基 (cysteine residue)」形成硫酯鍵 (thioester bond) 而活化,然後轉移至結合酶Atg10,以催化共價鍵結合至Atg5。進一步的研究顯示,Atg12: Atg5聚合物會徵募Atg16去形成3分子複合體,於第2個類泛素蛋白接合系統作為接合酶(ligase),對自噬作用扮演重要角色。在第2個特殊反應,Atg8的C端精胺酸(arginine) 受Atg4移除,且成熟的Atg8接著受到Atg7活化,轉移至Atg3接合酶。最後,這2個接合系統會合成Atg12: Atg5: Atg16接合酶,促使Atg8接合至「磷脂醯乙醇胺 (phosphatidylethanolamine)」。脂質化的Atg8是自噬小體 (autophagosome) 長度增加及融合的關鍵驅動因子。這2個結合系統,自酵母菌至哺乳動物,被高度保存下來。哺乳動物細胞中與酵母菌Atg8同源的蛋白質稱為LC3(light chain 3),現今,螢光標識的LC3已被廣泛用來作為自噬小體形成的生物標記。
大隅教授及研究團隊首先在哺乳動物細胞,辨識出類似酵母菌ATG基因的同源物質,使自噬作用功能的研究得以在較高等的真核生物展開。不久之後,遺傳學的研究發現,基因Atg5缺損小鼠在出生時明顯正常,但因無法應付餵食前的飢餓,出生後第一天就死亡。藉由自噬機制缺損的基因剔除模式小鼠研究,已證實在各種哺乳動物組織,自噬作用的重要性。
大隅教授開創性研究引發自噬作用的廣大興趣,該領域已成為生醫研究最密集的研究方向之一,從2000年代初期,發表論文數量即呈現顯著增加。
●不同類型的自噬作用
隨著大隅教授具有發展性的研究,根據被分解的物質,現在可區別不同自噬作用類型。受到最廣泛研究的自噬作用類型-巨自噬作用 (macroautophagy),能分解大部分細胞質及胞器。非選擇性的自噬作用 (non-selective autophagy),能連續不斷地發生,會受到如飢餓刺激有效地誘發。此外,針對特定基質(如蛋白質聚合物、細胞質內胞器、或入侵病毒或細菌)的選擇性自噬作用 (selective autophagy),,需要靠某些特定的接合分子,來辨識這些物質,運送至「自噬小體膜 (autophagosomal membrane)」上的Atg8或LC3。其它自噬作用類型包括「微自噬作用 (microautophagy)」,藉由「溶體膜 (lysosomal membrane)」向內摺疊直接吞噬細胞質成分,以及「伴護蛋白調控的自噬作用 (chaperone-mediated autophagy)」,具特定辨識訊號蛋白質,能藉鍵結至「伴護蛋白複合體 (chaperone complex)」,直接運送至溶體 (lysosome)。
●健康與疾病的自噬作用
自噬作用分子特徵所提供的觀點,有助於進一步理解在細胞生理學及各種病理狀態下,自噬作用的過程及關連性(圖3)。自噬作用最初被認為是細胞對刺激所產生的反應,但現在已瞭解該作用不斷地在進行基礎運作;不同於「泛素蛋白酶體系統 (ubiquitin-proteasome system)」優先分解存活時間較短的蛋白質,自噬作用能移除存活時間較長的蛋白質,是唯一能破壞整個胞器如粒線體 (mitochondria)、過氧化體(peroxisomes)、及內質網 (endoplasmic reticulum) 的作用。因此,自噬作用對維持細胞恆定,扮演重要的角色。此外,自噬作用參與各種生理過程,例如需移除大量細胞質的細胞分化及胚胎發育。不同類型的刺激能快速誘發自噬作用,構成細胞保護功能的基礎,能對抗細胞受損與老化有關連的許多疾病。
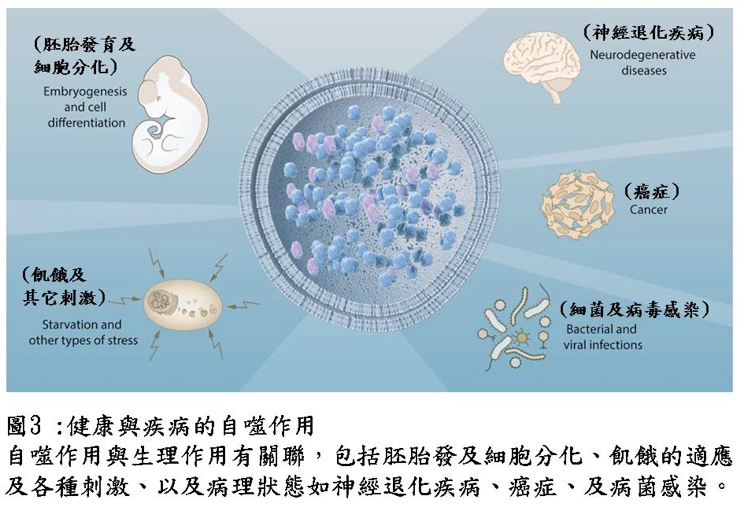
因為非正常運作的自噬作用常與人類各種的疾病直接或間接有關連,使得自噬作用成為疾病治療特別感興趣的標的。第一個自噬作用與疾病相關的例子,是來自蛋白質Beclin-1的觀察,Beclin-1是基因BECN1的產物,在多數人類乳癌及卵巢癌中皆出現突變。BECN1是酵母菌調節自噬作用啟動步驟基因ATG6的同源物質,這個發現使自噬作用在癌症所扮演角色,受到廣大的重視。
摺疊錯誤的蛋白質易形成不可溶的聚合物,對細胞具有毒性,細胞仰賴自噬作用來處理此問題。在神經退化疾病的果蠅及小鼠模式生物,藉抑制TOR激酶來活化自噬作用,能減少蛋白質聚合物的毒性。另外,腦組織的基因Atg5及Atg7受損,會造成小鼠腦部失去自噬作用,引起神經退化。許多人類體染色體隱性遺傳並伴隨自噬作用受損的疾病,會導致大腦畸形、發育遲緩、智商不足、癲癇、運動不協調、及神經退化等特徵。
自噬作用能消除入侵微生物,該現象稱為異源吞噬(xenophagy),對活化免疫反應及感染性疾病的控制扮演關鍵角色。病毒及細胞內細菌已發展出精巧的策略來迴避細胞防禦。另外,微生物能利用自噬作用來維持它們自身的成長。
●結論
大隅教授發現自噬作用基因及闡明自噬作用的分子機制,引導一個新的典範去理解細胞如何再利用它自己的成分。因為他的開創性研究,自噬作用已被確認為細胞生理學的一個基本作用,對人類健康及疾病具有重要涵義。
--
名詞解釋
Lysosome : 溶體,真核細胞的細胞質內胞器,含有包覆在膜內的分解酶。
Phagophore : 吞噬泡,巨自噬作用(macroautophagy)初期所形成的囊泡(vesicle),吞噬泡藉自噬機制擴展以吞噬細胞質成分。
Autophagosome : 自噬小體,包覆細胞質進入雙層膜的胞器,能與溶體(lysosome)融合,分解其成分。自噬小體是巨自噬作用(macroautophagy)的重要構造。
Selective autophagy : 選擇性自噬作用,巨自噬作用類型之一,能調控特定細胞質成分的分解,不同型式的選擇性自噬作用包括分解粒線體(mitochondria)的粒線體自噬(mitophagy)、分解核醣體(ribosome)的核醣體自噬(ribophagy)、分解脂肪滴(lipid droplets)的脂質自噬(ipophagy)、分解入侵微生物的異質吞噬(xenophagy)等。
內文及圖片來源:諾貝爾官網
