【2019 年諾貝爾生醫獎】一窺細胞如何「氧」尊處優

撰文|駱宛琳
每當十月一到,大家無不睜大眼睛等著新一年度的諾貝爾奬各個獎落誰家。禮拜一甫開出的諾貝爾生醫獎三位得主,你猜到了嗎?
今年的諾貝爾生醫獎,頒給了研究缺氧狀態下,細胞如何因應調節的生理機制;分別是為位於美國波士頓Dana-Farber Cancer Institute 的William Kaelin博士,身在巴爾的摩Johns Hopkins University 的Gregg Semenza博士,還有英國牛津Francis Crick Institute 的PeterRatcliffe博士。這研究或許不在所有人的得獎超級大熱門名單上,但卻絕對眾望所歸。
你如果看過Peter Thiel與 Blake Masters所著的《從 0到 1》,便知道任何一件事要從零做到一有多不簡單。而這三位科學家,不僅是成功地從零做到了一,更是在跨越出了那一大步之後,不論是自己實驗室的後續研究也好,或是啟發其他科學家的靈感也罷,讓缺氧環境的相關生理反應與調節,一路做到成千上萬、數不勝數。他們三人所一同開疆闢土、成就奠基的缺氧環境研究,對於各種細胞、各種疾病模式,皆影響深遠。事實上,這三位科學家在2016 年的時候,也一同獲頒有「諾貝爾前哨站」之稱的Lasker Award 殊榮。
那,這三位科學家是如何打開缺氧環境下的未知秘密呢?這故事,可是能夠一路追溯回九零年代。
細胞以「氧」為天:有「氧」能使細胞推磨,缺氧自是萬萬不能。但細胞如何知道周遭環境,是有氧還是無氧呢?
在當時,科學研究的主力都放在心臟、肺臟、與血液循環系統的構造與功能上。雖然對於這些臟器之於體內氧濃度恆定的調節維持相關研究,是多有成果,但這些假說與數據,都泰半侷限在以能量代謝反應為主的視角,卻不是以氧氣濃度為主角而看出去的視野。到底細胞自己,要如何感受到外在微環境裡的氧氣濃度,細胞自己又該如何決定一但有缺氧的狀況發生,該如何因應呢?
最早在1930 年代左右時,科學家就觀察到鈷中毒的患者,常常伴隨著一個臨床徵狀上的稀客:紅血球增多、增生。科學家很快就意識到,鈷鐵定是模仿了缺氧所能夠誘發的生理反應:製造紅血球生成素(erythropoietin,常簡稱為EPO)。但是,鈷既非主要代謝產物、廢物、毒物,可見,個體內紅血球生成素的產製,必定和體內氧氣濃度感測器是綁在一條船上的;而當個體鈷中毒的時候,不知怎地影響到了氧氣濃度感測器的迴路。
後來,更多的研究讓紅血球生成素與氧氣濃度的改變,成為定論。當氧氣濃度改變的時候,紅血球生成素的表現會增加,進而促進紅血球的生成。不過,要調節紅血球生成素的製造量,這可是很挑地方、也挑細胞的。製造主力之一是在腎臟,而Semenza博士與Ratcliffe博士所專注的肝臟細胞,也是另一處製造主力。但Ratcliffe博士實驗室很快地便發現,雖然製造紅血球生成素的細胞似乎得有特殊規格,但氧氣濃度感測器卻是各個細胞都裝上了一個。而Semenza博士更是第一個揭開了這個氧氣濃度感測器的神秘面紗:HIF (hypoxia-inducible factor)蛋白。這兩個團隊,找到在紅血球生成素基因上,有一段長約五十個鹼基的片段,和氧氣濃度的感測極有關係,而且能夠結合上一個特殊的轉錄因子,也就是HIF 是也。
他們和其他實驗室團隊也接著發現,HIF 蛋白並不是形單影隻,HIF 蛋白實際上是由兩個不同的、各自能和DNA 結合的轉錄因子所組成,是為HIF-1α 與HIF-1β。而HIF-1α 是能夠感測氧氣濃度的那個感應器。仔細研究之後,發現這兩個蛋白質的職責除了每個細胞都想管,還同時管很多基因。Semenza博士曾經表示,如果真要概括出一組數字的話,大概有百分之五的人類基因,都能夠受到這缺氧機制的調控。當然,是哪些基因受到調控,自然也得論細胞而自處了。但廣從細胞生長、分裂、存活,甚至是細胞移動,都可以受到HIF-1 的牽制。
HIF-1 的重要性也是從個體還在胚胎時期時就已經確立。如果在實驗小鼠模型上,把HIF-1α 的基因給剔除掉,那在實驗小鼠孕期第十天左右,胚胎就會停止發育了。這些小鼠胚胎,會因為剔除掉HIF-1α 基因而導致血管、心臟發育不全,可能是因為在缺少HIF-1α 基因的狀態下,血管無法正常形成。後來,更有其他科學家研究發現,胎盤要和子宮內層形成完整的血管網絡,也是需要HIF-1α 的正常運作。
而且,好笑的是,其實後來發現,紅血球生成素其實更是歸HIF 蛋白的近親:HIF2-α所管轄呢。
好的生物學答案,要能夠像骨牌一樣,回答完上一個問題便觸發了下一個問題的形成,如此一個接一個接力般地傳下去。在找到HIF-1α 是氧氣濃度感測器的真面目之後,接著,科學家便想知道,那其中的作用機制是什麼呢?
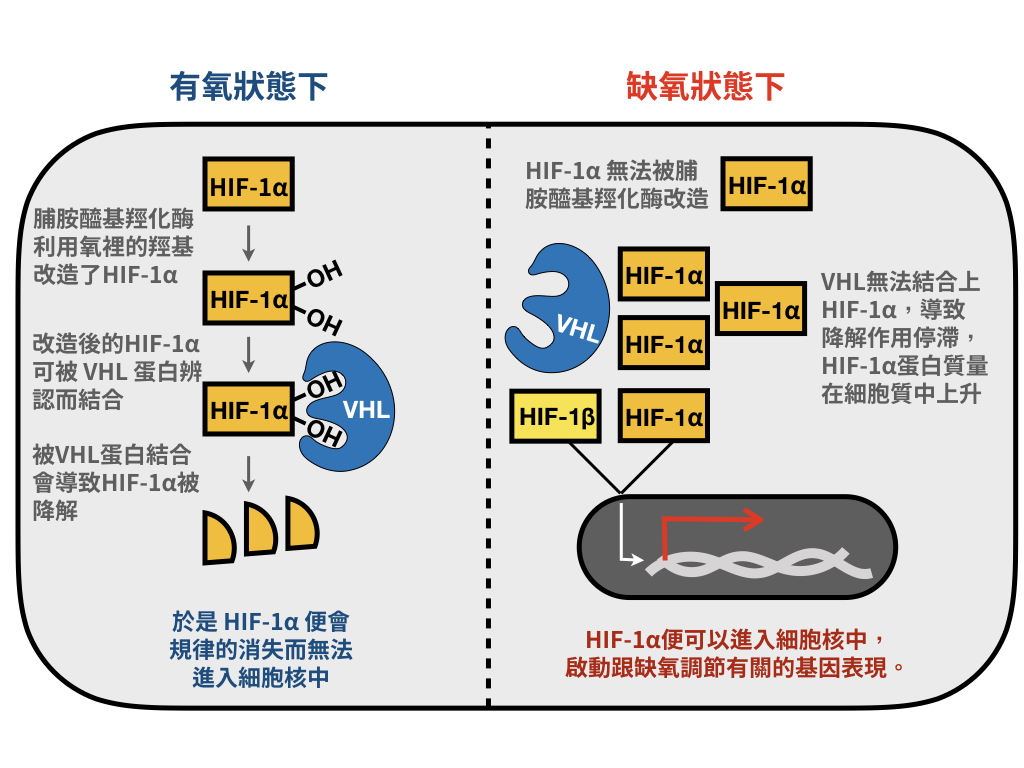
很多實驗室都證明,相較於HIF-1β 在細胞內的存量相對穩定,HIF-1α 的蛋白質量變動極大。不過,有趣的是,以HIF-1α 而言,這個蛋白質的消失,要比其存在,還更為細胞所關心。在一般正常氧量的環境底下,HIF-1α 蛋白質會被規律地降解掉,不過,一旦氧氣濃度太低的時候,HIF-1α 蛋白質就會逐漸積累到關鍵濃度,然後跑到細胞核裡,和HIF-1β 蛋白團員,去管控許多基因的表現。
而另一個今年諾貝爾桂冠得主Kaelin博士,便是解答出HIF-1α 蛋白質的降解是如何被調控的關鍵因素。Kaelin博士原本是研究一個叫做 VHL 的抑瘤基因。他們之所以對 VHL 基因感興趣,是因為一個跟此基因變異有關的罕見遺傳疾病——逢希伯-林道症候群(von Hippel–Lindau disease)。罹病的病患因為在VHL基因上帶有突變,而使得細胞生長不受控制過度增生,病患也有較高的風險會罹患許多種癌症。
Kaelin博士在研究VHL 基因的時候,除了證實其所編碼的蛋白質能夠防範癌症的發生,還發現當癌細胞缺少 VHL 基因的時候,會同時不正常地增高跟缺氧反應有關的基因。不過,當正常有功能的VHL 基因被重新引入癌細胞之後,這些缺氧反應有關的基因所編碼的蛋白質,又會被回復到正常的表現量。這是第一個明確的實驗證據指出,VHL 神奇地和缺氧反應的細胞內部調節機轉,息息相關。
後來,Kaelin博士和Ratcliffe博士實驗室(還有其他實驗室也一同努力),缺氧調控機制裡的繁複細節,才慢慢抽絲剝繭般的被釐清。結果顯示,當細胞處在正常氧氣濃度下的時候,HIF-1α 蛋白質會被脯胺醯基羥化酶(prolyl-hydroxylase)所作用,在兩處脯胺酸(proline)胺基酸的位置上「安裝上」羥基(—OH;hydroxyl group),這反應就叫做脯胺醯基羥化作用(prolyl-hydroxylation)。被胺醯基羥化後的HIF-1a 蛋白質會發生結構上改變,能夠被VHL 蛋白質所辨認而結合。一但被 VHL 蛋白質結合上的HIF-1α,就像是被好好裝在垃圾袋裡了,VHL 能夠進一步把泛素(ubiquitin)套在 HIF-1α身上,導致其被泛蛋白化而被降解。
反之,當細胞處在缺氧環境下的時候,沒有氧原料裡的羥基可供以脯胺醯基羥化HIF-1α,而沒有羥基的HIF-1α 就像是慣於濃妝艷抹後的素顏,VHL 蛋白質有眼卻識不得,不會將其拎進垃圾袋裡準備丟掉,於是,HIF-1α 濃度就會在細胞質裡逐漸攀高,而達到作用濃度了。
在缺氧環境下,細胞所因應的感應機制與生理調節不但可以套入任何細胞,癌細胞更是沒放過這個濫用此機制的機會。因此,在這條訊息傳導路徑上尋找可以「用藥」的靶點,也一直是新藥研發的重點所在。
諾貝爾醫學獎雖然只頒給了三位實至名歸的科學家,但更重要的是後續一棒接一棒,把這整個領域給發展成今日蓬勃之貌的所有科學家與研究團隊。如果,你身邊有人也在從事相關的研究,要記得也好好恭喜他喔!
諾貝爾得主的重要發表:
Semenza博士:
- Semenza, G.L, Nejfelt, M.K., Chi, S.M. &Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. ProcNatlAcadSci USA, 88, 5680-5684
- Wang, G.L., Jiang, B.-H., Rue, E.A. &Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. ProcNatlAcadSci USA, 92, 5510-5514
Ratcliffe博士:
- Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. &Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
- Jaakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. &Ratcliffe, P.J. (2001). Targeting of HIF-α to the von Hippel-Lindauubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472
Kaelin博士:
- Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. &Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
參考資料:
- Press release: The Nobel Prize in Physiology or Medicine 2019. The Nobel Assembly at KarolinskaInstitutet. https://www.nobelprize.org/uploads/2019/10/press-medicine2019.pdf
- Ledford H, Callaway E. Biologists who decoded how cells sense oxygen win medicine Nobel.Nature. 2019 Oct;574(7777):161-162. doi: 10.1038/d41586-019-02963-0.
- KaelinWGJr, RatcliffePJ, Semenza GL.Pathways for Oxygen Regulation and Homeostasis: The 2016 Albert Lasker Basic Medical Research Award.JAMA. 2016 Sep 27;316(12):1252-3. doi: 10.1001/jama.2016.12386.
- Marx J.Cell biology. How cells endure low oxygen.Science. 2004 Mar 5;303(5663):1454-6.PMID: 15001751 DOI: 10.1126/science.303.5663.1454
