歐美COVID-19疫苗的最新發展
嚴重的急性呼吸系統症候群冠狀病毒2(SARS-CoV-2)造成的冠狀病毒感染症2019(Covid-19),在近2年的全球大流行中已感染了數千萬人,並造成超過兩百萬人死亡,所以安全且有效的疫苗顯得迫切需要。最近一年多來世界各國競相研發疫苗,目前歐美國家已開發成功並實際用於接種的疫苗主要有輝瑞疫苗、莫德納疫苗及牛津疫苗三種。我們在本文將簡介這三種疫苗的臨床試驗,並對其研發過程、效力(保護力)及安全性進行探討及比較。
撰文|陳淵銓
●COVID 疫苗研發
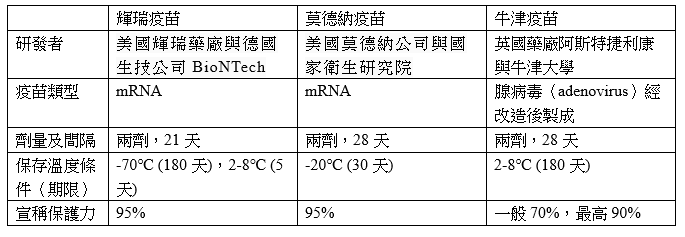
歐美國家入秋後飽受COVID-19疫情反撲之苦,台灣近日亦爆發醫護人員院內感染案例,所以亟需開發疫苗以保護高風險的人,世界各國莫不希望疫苗盡快上市以達預防Covid-19的效果。根據COVID-19疫苗研發追蹤統計,全球研製中的疫苗多達78種,目前西方國家研發進度最快的是輝瑞(Pfizer)、莫德納(Moderna)及牛津疫苗,已在美國及歐洲申請緊急授權,英國則已核准輝瑞疫苗緊急使用(表一)。
●輝瑞疫苗
在2020年,美國輝瑞藥廠與德國生技公司BioNTech合作進行一項安慰劑對照(placebo control)及觀察者盲目(observer-blinded)的關鍵療效試驗中,以1:1的比例隨機分配16歲以上的人,共有43548名參與者進行了隨機分組,共有43448人接受了接種,其中21720人注射BNT162b2候選疫苗(輝瑞疫苗),BNT162b2疫苗是一種經過修飾的mRNA疫苗,可編碼融合前穩定的SARS-CoV-2全長棘突蛋白(spike protein,人體免疫系統對抗冠狀病毒的主要靶標),用於確認對抗Covid-19的效力(efficacy)和安全性(safety);另外的21728人注射安慰劑(placebo)。受試者間隔21天接受兩劑脂質奈米顆粒(lipid nanoparticle)配製的BNT162b2疫苗(30 μg/dose)或安慰劑。研究人員發現在第二次接種BNT162b2疫苗的受試者中,至少有7例在第二次給藥後,7天內出現了Covid-19症狀;而在接受安慰劑的受試者中,則有162例。研究結果顯示BNT162b2疫苗預防Covid-19的效力為95%(可信度區間[confidence interval, CI]為95%,從90.3至97.6)。在根據年齡、性別、種族、身體質量指數(body mass index)及共存條件而定義的亞組(subgroup)中,觀察到相似的疫苗效力(通常為90-100%)。在接種首劑疫苗後的10例Covid-19嚴重患者中,安慰劑接受者佔9例,而BNT162b2疫苗接受者則僅有1例。BNT162b2疫苗的副作用通常僅於注射部位有短期、輕度至中度疼痛及頭痛、疲勞等,嚴重不良事件很少發生,而且與安慰劑組發生率接近。試驗結果得知 BNT162b2疫苗的兩劑方案可為16歲以上的人提供針對SARS-CoV-2感染約95%的保護力。
●莫德納疫苗
在2020年,美國莫德納公司與國家衛生研究院(National Institute of Health, NIH)合作開發一種脂質奈米顆粒包裹的mRNA-1273疫苗(莫德納疫苗),可編碼SARS-CoV-2的全長棘突蛋白。該疫苗第三期觀察者盲目及安慰劑對照的臨床試驗在美國99個中心進行,共招募了30420名志願受試者,以1:1的比例隨機分配以接受疫苗或安慰劑(每組15210名受試者)。超過96%的受試者接受了以上兩種注射,並且有2.2%的受試者在基線(baseline)時有SARS-CoV-2感染的證據(血清學、病毒學或兩者兼有)。將SARS-CoV-2感染者或其併發症的患者以1:1的比例隨機分配,間隔28天接受兩次肌肉注射mRNA-1273疫苗(100 μg/dose)或安慰劑。在安慰劑組的185名參與者(每千人56.5/年,95%CI從48.7至65.3)和在mRNA-1273組的11名參與者(每千人3.3/年,95%CI,從1.7至6.0)中證實有了Covid-19的症狀。疫苗效力為94.1%(95%CI,89.3至96.8%,P <0.001)。在首次接種後14天的評估,分析基線時有SARS-CoV-2感染及65歲以上的受試者,療效均相似。嚴重的Covid-19症狀發生在30名參與者(其中1名死亡),但所有30位患者均屬於安慰劑組,中度、短暫的不良反應雖然時常在mRNA-1273疫苗組發生,可是嚴重不良事件很少見,而且與安慰劑組發生率接近。
●牛津疫苗
在2020年,英國牛津大學(Oxford University)和阿斯特捷利康(AstraZeneca)製藥公司自黑猩猩的糞便中分離出腺病毒(adenovirus),此病毒在改造後製成牛津疫苗。改造後的腺病毒雖然在細胞中不會複製,但注射後會誘發人類細胞產生SARS-CoV-2棘突蛋白。根據在英國和巴西的11000多名受試者中的131個COVID-19病例,研究人員在受試者接受第二劑疫苗2週後測定效力,發現這兩劑疫苗的效力約為70%。初步分析臨床試驗第三期的數據,平均有效率約為70%,此數據是兩種接種方案中62%和90%效力的平均值,紐約市西奈山醫學院的病毒學家弗洛里安(Florian Krammer)認為90%的效力相當不錯,但是第二種測試方案的62%的效力並不理想。然而,研究人員進一步分析結果後發現,根據遞送給受試者的疫苗數量,效力存在顯著差異。在相隔1個月兩個全劑量方案中,發現只有62%有效,但與安慰劑組的受試者相比,顯現在第一劑中接受較低劑量的疫苗然後在第二劑中接受全劑量疫苗的受試者,他們感染SARS-CoV-2的可能性降低約90%。
參考資料:
- Schaefer GO, Tam CC, Savulescu J, Voo TC. COVID-19 vaccine development: Time to consider SARS-CoV-2 challenge studies? Vaccine. 2020 Jul 14;38(33):5085-5088. doi: 10.1016/j.vaccine.2020.06.007. Epub 2020 Jun 4.
- Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 31;383(27):2603-2615. doi: 10.1056/NEJMoa2034577. Epub 2020 Dec 10.
- Ledford H. Moderna COVID vaccine becomes second to get US authorization. 2020 Dec 18. doi: 10.1038/d41586-020-03593-7. Online ahead of print.
- Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, Diemert D, Spector SA, Rouphael N, Creech CB, McGettigan J, Kehtan S, Segall N, Solis J, Brosz A, Fierro C, Schwartz H, Neuzil K, Corey L, Gilbert P, Janes H, Follmann D, Marovich M, Mascola J, Polakowski L, Ledgerwood J, Graham BS, Bennett H, Pajon R, Knightly C, Leav B, Deng W, Zhou H, Han S, Ivarsson M, Miller J, Zaks T; COVE Study Group. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. 2020 Dec 30: NEJMoa2035389. doi: 10.1056/NEJMoa2035389. Online ahead of print.
- Why Oxford’s positive COVID vaccine results are puzzling scientists. Nature news. 2020 Nov. 23. doi: https://doi.org/10.1038/d41586-020-03326-w
