胰臟癌與高糖的關係
隨著人口老化及飲食西化,近年國內胰臟癌患者有逐漸增加的趨勢。胰臟癌是一種惡性極高的癌症並有「癌王」之稱,有超過85 %的患者無法以手術進行治療,五年的存活率平均更是低於5%。然而,致癌危險因子的研究有助於胰臟癌的預防及治療,我們在本文將引領讀者認識胰臟癌,並探索胰臟癌與高糖的關係。
撰文/陳淵銓
胰臟癌的認識
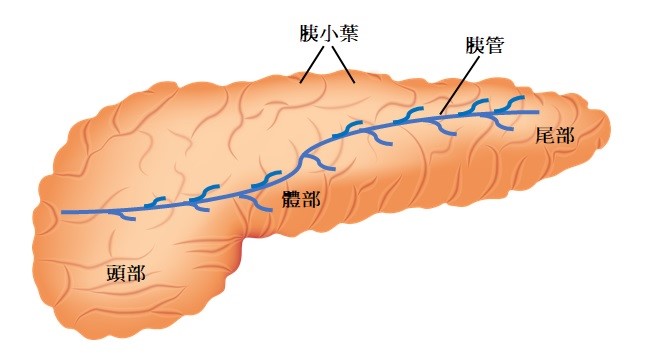
胰臟是長條形且呈扁平狀的器官,位於後腹腔且橫跨於脊椎及主動脈上,可分為頭部、體部及尾部三部分,會分泌胰液(內含酵素)和激素(賀爾蒙)以供身體內消化作用及維持平衡所需,兼具外分泌腺及內分泌腺的功能。胰液經過胰臟的腺管送出到小腸,用來分解醣類、蛋白質、脂肪及核酸;胰臟內類似獨立小島的「蘭氏小島(胰島)」(islet of Langerhans)則會產生胰島素(insulin)、升糖素(glucagon)、體抑素(somatostatin)、生長激素釋放激素(ghrelin)及胰多肽(pancreatic polypeptide),這些激素會直接經由血管送到身體各處,以維持體內醣類代謝及生長的平衡。在台灣,依已知數據初步統計顯示,在胰島產生癌細胞所造成的胰臟癌約佔5-10%,而胰臟腺管產生的癌症稱為胰腺癌(pancreatic adenocarcinoma)約佔90-95%。
胰臟癌是癌症之王
在台灣,胰臟癌與跟其他癌症(如肺癌、大腸癌、胃癌、乳癌、子宮頸癌等)相較,發生率雖不算高,但臨床上有高達85%病患確診時已是晚期而無法開刀,即便有動手術的機會,仍有不少患者會復發,確診幾乎等於宣告死亡,所以胰臟癌令人聞之色變而使有「癌症之王」的稱號,主要原因如下:
1.很難早期發現:胰臟位於腸胃道後方的腹腔深處而檢查不易,早期也幾乎無任何症狀,即便出現症狀,很容易被誤認為是腸胃道不適而忽略。
2.篩檢不易:腹部超音波易受旁邊腸胃道氣體干擾,很難全面觀察到胰臟是否有變化;電腦斷層及磁振造影檢查必須注射顯影劑,而且小於2公分的腫瘤約有三分之一到四分之一的機率無法看到或看不清楚;內視鏡超音波是目前診斷早期胰臟癌靈敏度最高的方法,可清楚看到小於1公分的腫瘤,但內視鏡前端必須伸入胃及十二指腸,用前端的超音波探頭去觀察胰臟,為一種侵入性檢查,在過程中存在一定程度的風險,並不建議用於第一線篩檢。
3.療效不佳:目前最有效的方法是手術切除腫瘤,但臨床上僅有15%的患者適合開刀,無法接受手術者,只能採用化學、放射、標靶或免疫治療來緩解病情及延長存活期,但效果均不理想。
4.復發率高:胰臟癌極易擴散到其他器官及侵犯重要血管,很多病患開刀後才發現有許多癌細胞早已轉移到其他器官,因此臨床上復發率高達80%以上,預後亦很差。
胰臟癌與高糖的關係
造成胰臟癌的原因至今仍不明確,但可能的危險因子包括年齡(大於60歲)、抽菸、喝酒、慢性胰臟炎、糖尿病、曾接受胃部切除手術、長時間接觸化學品及特殊飲食習慣(如愛吃紅肉、高脂及高糖食品)等,相關研究仍在持續進行中,其中以高糖與胰臟癌的關係是近來研究的重點。
KRAS基因是促進細胞生長與存活的基因,當其發生突變時,細胞分裂會難以控制而可能造成腫瘤細胞生成,臨床上已發現超過90%的胰腺癌病人檢體有KRAS基因突變。在2019年,台灣研究人員在動物實驗中,發現若長期餵食小鼠高糖高脂的食物造成其高血糖後,小鼠的主要器官只有胰臟會出現明顯基因組受損和KRAS基因突變的狀況。他們再用正常的胰臟細胞作實驗,投與高濃度的糖、蛋白質及脂肪作為培養基,結果顯示只有高糖會讓胰臟細胞產生基因的變異。進一步研究更發現在高糖環境下,細胞內的O-GlcNAcylation作用顯著提高,這種轉譯後修飾會降低核糖核苷酸還原酶(ribonucleotide reductase, RNR)的活性,使得合成基因生成和複製所需的四種脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate, dNTP)的量均明顯降低。生產dNTP的製程被過多的糖所擾亂,造成了dNTP的短缺,使得在胰臟細胞的基因組複製過程中,當有損傷需要修補時,因原料不足而發生錯誤,導致KRAS基因突變,引發胰臟細胞的癌化。
甾醇調節元件結合蛋白1(sterol regulatory element binding protein 1, SREBP1)是參與脂質代謝和腫瘤擴展的重要轉錄因子(transcription factor),但是在高糖微環境(high glucose microenvironment)下,SREBP1和胰腺癌的關係仍有待了解。在2019年,中國研究人員在特定培養基中培養胰臟癌細胞,使用免疫組織化學法(mmunohistochemistry)和西方墨點法(蛋白質轉漬法,Western blotting)來檢測SREBP1的表現。他們發現高血糖水平與胰腺癌患者的預後不良有密切關係,SREBP1在胰腺癌組織和細胞中均表現過量。研究結果顯示高糖微環境會藉由增強SREBP1的表現,來促進腫瘤增殖、抑制細胞凋亡(apoptosis)及降低自噬(autophagy)水平。此外,自噬的激活(activation)會加速SREBP1的表現,並抑制細胞凋亡,這意味著SREBP1可能是胰腺癌預防和治療的新目標。
參考資料:
- Zhou C, Qian W, Li J, Ma J, Chen X, Jiang Z, Cheng L, Duan W, Wang Z, Wu Z, Ma Q, Li X. High glucose microenvironment accelerates tumor growth via SREBP1-autophagy axis in pancreatic cancer. J Exp Clin Cancer Res. 2019 Jul 11;38(1):302. doi: 10.1186/s13046-019-1288-7.
- Hu CM, Tien SC, Hsieh PK, Jeng YM, Chang MC, Chang YT, Chen YJ, Chen YJ, Lee EYP, Lee WH. High glucose triggers nucleotide imbalance through O-GlcNAcylation of key enzymes and induces KRAS mutation in pancreatic cells. Cell Metab. 2019 Jun 4;29(6):1334-1349.e10. doi: 10.1016/j.cmet.2019.02.005. Epub 2019 Mar 7.
- Ansari D, Tingstedt B, Andersson B, Holmquist F, Sturesson C, Williamsson C, Sasor A, Borg D, Bauden M, Andersson R. Pancreatic cancer yesterday, today and tomorrow. Future Oncol. 2016 Aug;12(16):1929-46. doi: 10.2217/fon-2016-0010. Epub 2016 Jun 1.
