盤點COVID-19疫苗的製造技術
自COVID-19疫情在全球爆發大流行後,接種疫苗已成為防疫的最關鍵有效的方法。疫苗的研發、製作及試驗屬於尖端生物科技,全世界只有少數國家有能力執行並完成。在此世界各國競相研製及引進疫苗之際,已有部分疫苗獲得或即將獲得WHO批准或大多數國家的緊急使用授權,我們在本文將探索並比較這些COVID-19疫苗的製造技術。
撰文/陳淵銓
●製造疫苗的技術
疫苗是用病原微生物(如細菌、病毒等)製成可使生物體產生特異的適應性免疫反應(adaptive immunity)之生物製劑。每種外來病原體都具有特異的蛋白質成分稱為”抗原“,當微生物侵人體時,因為人體免疫系統具有辨識敵我的能力,對於入侵的病原體便會加以辨認並消滅之。人體免疫系統具有專一性及記憶性兩種重要的特性:專一性是指一種抗體只能辨識及對付一種抗原,所以人體需要製造各種抗體才能對付多變的外來抗原;記憶性是指再度遇到相同的病原體抗原時,人體便能迅速反應產生大量有效的抗體。依製造的技術可區分成下列幾種疫苗:
1.不活化或滅活疫苗(inactivated vaccine):將病原微生物不活化(失活)後,保留全微生物體製成的疫苗。
2.活減毒活疫苗(live attenuated vaccine):藉由化學物質來減少病原微生物的致病力,但仍使微生物保持存活而製成的疫苗。
3.次單位疫苗(subunit vaccine):利用病原微生物表面的有效抗原(抗原決定因子)製備的疫苗。
4.重組蛋白疫苗(recombinant protein vaccine):利用遺傳工程技術將特定蛋白質改造成類似病原微生物的有效抗原而製成的疫苗。
5.DNA疫苗(DNA vaccine):注射含有編碼引起所需免疫反應抗原的DNA序列質體到細胞內,使細胞會直接產生抗原,從而引起免疫反應。
6.信使RNA疫苗(mRNA vaccine):利用mRNA轉譯產生特異性蛋白質引發人體產生免疫反應,但因mRNA對溫度敏感且易被RNA分解酶(RNase)分解,所以必須將其包裹在適當載體中,以保護疫苗不受破壞。
●疫苗載體
載體是一種可將用於合成抗原的遺傳物質運送至人體宿主細胞的物質或微生物,藉以提高遞送的效率。目前被核准用於製作 COVID-19 疫苗的載體如下:
1.腺病毒(adenovirus):利用重組腺病毒作為載體將可編碼標的蛋白之DNA序列帶入人體細胞內。原理是刪除病毒載體的自行複製能力,再將一段可製造病毒棘突蛋白(spike protein)的DNA放入腺病毒基因序列中,最後將之遞送至人體細胞,製造抗原以刺激免疫系統。病毒載體除了不會在人體內大量複製及無傳統疫苗危險性外,還可同時引發先天性免疫反應(innate immunity)及適應性免疫反應。此種載體的優點是製作簡單、安全及有效,並能夠對使用者產生全面且長期性的保護效果。
2.奈米粒子(nanoparticle):奈米膠囊的技術可以將核酸(DNA或 RNA)以及其他長鏈分子包裝入很小的奈米粒子中,後來發現將聚乙二醇(polyethylene glycol, PEG)加在奈米粒子的表面,可以延長其在體內存留的時間。近來更發展出脂質奈米粒子(lipid nanoparticle),可以避免RNA被分解或破壞,亦能有效協助RNA通過細胞膜。在2018年,美國食品藥物管理局(FDA)批准了脂質奈米粒子作為RNA的載體,目前莫德納和輝瑞的mRNA疫苗都是採用含有PEG的脂質奈米粒子作為載體。
●主要 COVID-19疫苗之比較
截至2021年6月1日,世界衛生組織(WHO)共批准了六種COVID-19疫苗在全球的緊急使用,包括輝瑞/BNT、莫德納、牛津-阿斯特捷利康(包括由印度生產的COVISHIELD)、嬌生、國藥(BBIBP-CorV)及科興生物(CoronaVac)疫苗。歸納獲得WHO批准及其他國家緊急使用授權(Emergency Use Authorization, EUA)的主要COVID-19疫苗如下表:
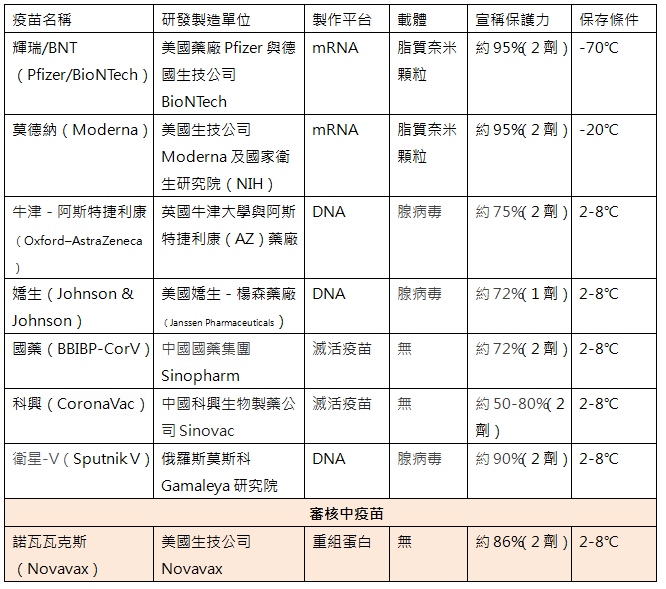
諾瓦瓦克斯COVID-19疫苗屬於重組蛋白疫苗,乃採用蛋白質次單位及奈米粒子技術,在細胞內複製無害的病毒棘突蛋白,抽取純化後打入人體,使免疫細胞能辨認之而引起免疫反應。原理是先改造含有製造SARS-CoV-2棘突蛋白基因的桿狀病毒(baculovirus),感染昆蟲細胞後產生棘突蛋白,再將棘突蛋白純化收集後,包裝入脂質奈米粒子內作成疫苗,並含有皂苷(saponin)作為佐劑(adjuvant)。目前此疫苗已完成三期臨床試驗並正申請審查中,亦有部分國家表達購買或代工生產的意願,但迄未獲得任何國家的正式批准。
接種疫苗必須兼顧合法性、有效性及安全性,其中有效性及安全性的評估結果常會依地域、國家、種族、性別、年齡及個體遺傳而有差異,例如:同一支 COVID-19疫苗在不同的臨床試驗中展現的保護效力及副作用便經常顯著不同,特別是副作用發生的嚴重程度及機率與個人體質(遺傳)密切相關,很難對其作有意義的科學性評估。因此,COVID-19疫苗的選擇及使用實在是一門很深奧的科學。
參考資料
1.Palacios R, Patiño EG, de Oliveira Piorelli R, Conde MTRP, Batista AP, Zeng G, Xin Q, Kallas EG, Flores J, Ockenhouse CF, Gast C. Double-Blind, Randomized, Placebo-Controlled Phase III Clinical Trial to Evaluate the Efficacy and Safety of treating Healthcare Professionals with the Adsorbed COVID-19 (Inactivated) Vaccine Manufactured by Sinovac - PROFISCOV: A structured summary of a study protocol for a randomised controlled trial.Trials. 2020 Oct 15;21(1):853. doi: 10.1186/s13063-020-04775-4.
2.Al Kaabi N, Zhang Y, Xia S, Yang Y, Al Qahtani MM, Abdulrazzaq N, Al Nusair M, Hassany M, Jawad JS, Abdalla J, Hussein SE, Al Mazrouei SK, Al Karam M, Li X, Yang X, Wang W, Lai B, Chen W, Huang S, Wang Q, Yang T, Liu Y, Ma R, Hussain ZM, Khan T, Saifuddin Fasihuddin M, You W, Xie Z, Zhao Y, Jiang Z, Zhao G, Zhang Y, Mahmoud S, ElTantawy I, Xiao P, Koshy A, Zaher WA, Wang H, Duan K, Pan A, Yang X. Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults: A Randomized Clinical Trial.JAMA. 2021 May 26. doi: 10.1001/jama.2021.8565. Online ahead of print.
3.Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, Kovyrshina AV, Lubenets NL, Grousova DM, Erokhova AS, Botikov AG, Izhaeva FM, Popova O, Ozharovskaya TA, Esmagambetov IB, Favorskaya IA, Zrelkin DI, Voronina DV, Shcherbinin DN, Semikhin AS, Simakova YV, Tokarskaya EA, Egorova DA, Shmarov MM, Nikitenko NA, Gushchin VA, Smolyarchuk EA, Zyryanov SK, Borisevich SV, Naroditsky BS, Gintsburg AL; Gam-COVID-Vac Vaccine Trial Group. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021 Feb 20;397(10275):671-681. doi: 10.1016/S0140-6736(21)00234-8. Epub 2021 Feb 2.
4.Heath, Paul T.; Galiza, Eva P.; Baxter, David Neil; Boffito, Marta; Browne, Duncan; Burns, Fiona; Chadwick, David R.; Clark, Rebecca; Cosgrove, Catherine; Galloway, James; Goodman, Anna L.; Heer, Amardeep; Higham, Andrew; Iyengar, Shalini; Jamal, Arham; Jeanes, Christopher; Kalra, Philip A.; Kyriakidou, Christina; McAuley, Daniel F.; Meyrick, Agnieszka; Minassian, Angela M.; Minton, Jane; Moore, Patrick; Munsoor, Imrozia; Nicholls, Helen; Osanlou, Orod; Packham, Jonathan; Pretswell, Carol H.; Ramos, Alberto San Francisco; Saralaya, Dinesh; Sheridan, Ray P.; Smith, Richard; Soiza, Roy L.; Swift, Pauline A.; Thomson, Emma C.; Turner, Jeremy; Viljoen, Marianne Elizabeth; Albert, Gary; Cho, Iksung; Dubovsky, Filip; Glenn, Greg; Rivers, Joy; Robertson, Andreana; Smith, Kathy; Toback, Seth. Efficacy of the NVX-CoV2373 Covid-19 Vaccine Against the B.1.1.7 Variant. medRxiv. 2021-05-14[2021-05-25]. doi:10.1101/2021.05.13.21256639.
