巨細胞病毒感染的細胞治療
人類巨細胞病毒(human cytomegalovirus, HCMV)引發的疾病嚴重威脅著免疫力較弱者的健康,如接受器官移植的病人。儘管相關治療方法有新的進展,但目前用於治療急性(acute)HCMV感染的藥物療效仍十分有限,不但無法根除潛伏性感染,且曾發生腎毒性等副作用及產生抗藥性病毒株的問題。幸運的,過繼性T細胞療法已被實驗性的用於對抗器官移植接受者體內的耐藥性和潛伏復發性的HCMV,此新開發對抗病毒的方法可望取得豐碩的成果,並將對治療HCMV的感染產生重大影響。
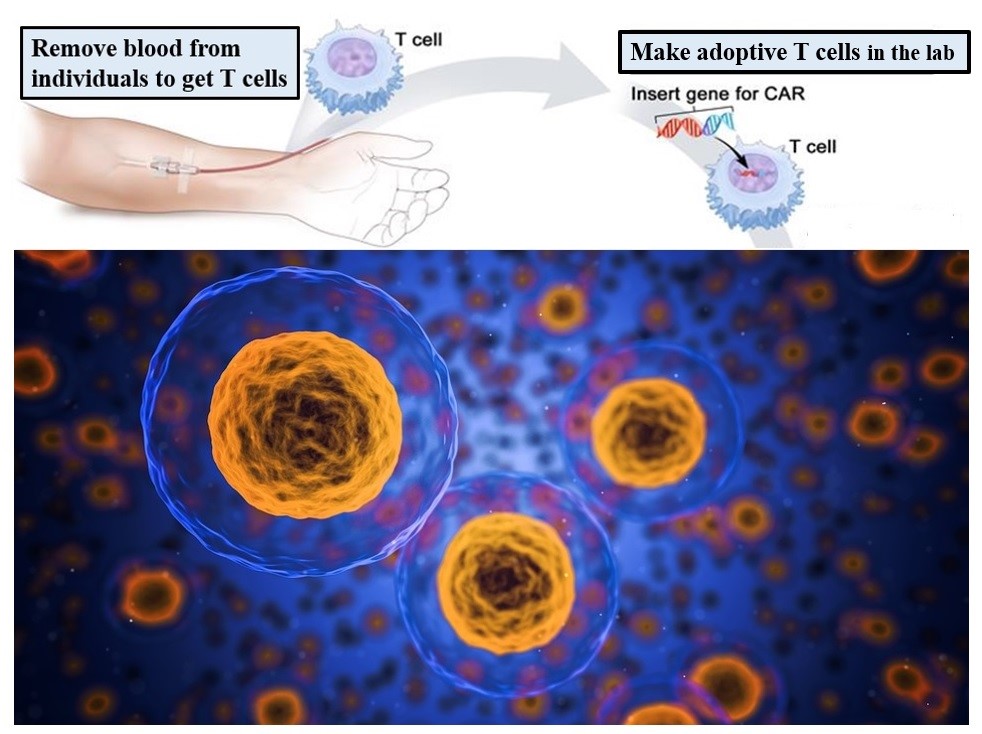
文/陳淵銓
●HCMV感染的藥物治療
現今已有一些作用方式為抑制病毒DNA聚合酶(polymerase)的抗病毒藥物(如ganciclovir, valganciclovir, cidofovir, foscarnet)用於治療急性的HCMV感染,其中ganciclovir是第一線用藥,但這些傳統藥物的有效性仍受到副作用、交叉耐藥性及其他因素的干擾而受到限制。
Letermovir是一種新型抗病毒藥,已被美國食品藥品監督管理局(Food and Drug Administration, FDA)和歐洲藥品管理局(European Medicines Agency, EMA)批准用於預防或治療急性的HCMV感染,已在HCMV感染患者中進行了測試,對器官移植者或人類免疫缺陷病毒(human immunodeficient virus, HIV)感染患者有用。與傳統的抗病毒藥物比較,Letermovir具有以下優點:(1)可以口服,故患者無須住院和靜脈注射;(2)毒性較輕,且無骨髓毒性和腎毒性;(3)標靶作用在HCMV的終端酶複合物(terminase complex),而不是DNA聚合酶,因此不會有與現有抗病毒藥物發生交叉耐藥性(cross-resistance)的風險。然而,此種新藥仍需要更多的數據來提供病患體內檢測到的病毒突變的見解、基因分型結果的解釋及臨床相關性的結果,亦應建立藥物上市後的監控系統和監測HCMV是否產生耐藥性的數據資料庫。
傳統藥物用於急性HCMV感染的預防或治療的效果仍有諸多限制和有待驗證之處,而且目前發展可同時治療HCMV急性和/或潛伏性(latent)感染的藥物正逐漸成為受到注重之焦點,因此更新穎的治療方法-細胞治療便因應需求而發展出來。
●HCMV感染的細胞治療
眾所周知,如果器官移植接受者的體內T細胞介導的免疫作用(cell-mediated immunity)受到損害,則微生物感染相關的發病率和死亡率將會增加。對病毒具有特異性的T細胞能夠在同種異體(allogeneic)的造血幹細胞移植(hematopoietic stem cell transplantation, HSCT)後,標靶作用到患者體內的多種病原體,如HCMV、鼻咽病毒(Epstein-Barr virus, EBV)和腺病毒(adenovirus)等。過繼性T細胞治療(adoptive T cell therapy)是將T細胞給予患者用以治療疾病的一種細胞免疫療法(cellular immunotherapy),可在實體器官移植(solid organ transplant, SOT)接受者體內,利用加工改造過的T細胞對抗耐藥性和潛伏後復發的HCMV。因此,過繼性T細胞治療已成為HSCT和SOT接受者體內HCMV感染復發時的有效治療策略之一。
在2019年,德國科學家Faist等人使用了胜肽特異性增殖測定法(peptide specific proliferation assay) 研究對HCMV具有特異性的中央記憶T細胞 (central memory T cells, TCM)的組成,並確定其在活體外的功能和增殖能力。在動物實驗中,HCMV特異性的TCM甚至在低劑量時也具有保護能力,而且可以長期的存活和廣泛的增殖,並在過繼轉移後仍展現出高度可塑性(plasticity)。儘管臨床數據表明,純化的HCMV表位特異性T細胞在最低劑量便能夠排除病毒血症(viremia),但仍有必要評估在人體的病毒特異性TCM是否仍具有與小鼠相同的過繼性T細胞治療特性。研究結果顯示,低劑量的TCM便具有預防性的過繼性T細胞治療的潛力,這些符合優良藥品製造規範(Good manufacturing practice, GMP)的TCM可作為HSCT患者的廣效性抗病毒T細胞。總之,T細胞的過繼轉移解決了重要的臨床需求,而且既有效又安全,故最近將最佳的過繼性T細胞產品發展的焦點轉向於使用具有特定分化特徵的T細胞亞群(subset),而非只有考慮抗原特異性。
在2019年,澳洲科學家 Smith等人報導了在實體器官移植接受者體內,已成功使用過繼性T細胞治療來對抗耐藥性及復發性HCMV。他們更進一步使用高通量T細胞受體Vβ定序(sequencing)和T細胞功能分析(profiling),測試過繼性T細胞對於治療前免疫T細胞指令重塑(repertoire remodeling)和評估細胞治療產品的效能。臨床反應與治療後T細胞受體Vβ格局的變化顯然是一致的,在有反應的患者體內,這種重塑與有效應的TCM出現有相關性;而在無反應的患者體內,在過繼性T細胞治療後表現出變化最小的治療前T細胞增殖。本研究結果顯示,接受過繼性T細胞治療後,免疫調節需要顯著的指令重塑,因為在先前的免疫環境中,無反應的患者的指令重塑能力可能會受損,而控制這種環境的免疫干預措施可能會改善臨床治療的效果。因此,過繼性T細胞治療似乎是恢復對抗HCMV的免疫控制的有利策略,並可治療因免疫力受到抑制而受到HCMV感染的患者,如SOT接受者。
●結論
細胞免疫療法正在成為一種絕佳的策略,用以恢復個體對抗HCMV和其他病原體的免疫控制能力,從而治療實體器官移植者和其他免疫系統受到抑制的患者。藉由了解治療前的免疫環境和治療後與免疫控制相關的變化,將提供研究人員一個平台與途徑,有助於增強細胞免疫療法的未來臨床應用。
參考資料:
- Chen SJ, Wang SC, Chen YC. Antiviral agents as therapeutic strategies against cytomegalovirus infections. Viruses. 2019 Dec 23;12(1). pii: E21. doi: 10.3390/v12010021. Review.
- Fatic A, Zhang N, Keller MD, Hanley PJ. The pipeline of antiviral T-cell therapy: What’s in the clinic and undergoing development. Transfusion. 2020 Jan; 60(1):7-10. doi: 10.1111/trf.15501. Epub 2019 Aug 30.
- Faist B, Schlott F, Stemberger C, Dennehy KM, Krackhardt A, Verbeek M, Grigoleit GU, Schiemann M, Hoffmann D, Dick A, Martin K, Hildebrandt M, Busch DH, Neuenhahn M. Targeted in-vitro-stimulation reveals highly proliferative multi-virus-specific human central memory T cells as candidates for prophylactic T cell therapy. PLoS ONE, 2019 Sep 30;14(9): e0223258. doi: 10.1371/journal.pone.0223258. eCollection 2019.
- Smith C, Corvino D, Beagley L, Rehan S, Neller MA, Crooks P, Matthews KK, Solomon M, Le Texier L, Campbell S, Francis RS, Chambers D, Khanna R. T cell repertoire remodeling following post-transplant T cell therapy coincides with clinical response. J. Clin Invest. 2019 Nov 1;129(11):5020-5032. doi: 10.1172/JCI128323.
