2019-nCoV (COVID-19) 感染的篩檢及鑑定
 新型冠狀病毒(2019-nCoV)的大流行已給予全球公共衛生及人類健康帶來了嚴峻的挑戰,越來越多的證據表明這種爆發比最初的想像更廣泛,為了早日識別出受到感染的患者,以爭取治療時間,避免疫情擴散,所以進行快速檢測2019-nCoV的分子檢測是迫切需要的。在本文我們將介紹及探討可用於檢測COVID-19患者的篩檢及鑑定的方法:定量即時逆轉錄聚合酶連鎖反應分析及免疫快篩試劑。
新型冠狀病毒(2019-nCoV)的大流行已給予全球公共衛生及人類健康帶來了嚴峻的挑戰,越來越多的證據表明這種爆發比最初的想像更廣泛,為了早日識別出受到感染的患者,以爭取治療時間,避免疫情擴散,所以進行快速檢測2019-nCoV的分子檢測是迫切需要的。在本文我們將介紹及探討可用於檢測COVID-19患者的篩檢及鑑定的方法:定量即時逆轉錄聚合酶連鎖反應分析及免疫快篩試劑。
文/陳淵銓
●定量即時逆轉錄聚合酶連鎖反應分析(quantitative real-time reverse transcription polymerase chain reaction assay, qRT-PCR)
目前國際上最廣泛使用的方法,準確性及靈敏度經過驗證及確效,檢測時間約需4小時。分析方法要點如下:
1. 可接受的檢體
(1)呼吸道樣本(respiratory specimen):鼻咽或口咽的吸出物(aspirate)、洗出液(wash)或拭出物(swab);支氣管肺泡灌洗液(lavage);氣管吸出物及痰液(sputum)。
(2)血清(serum):抽取血液以分離出血清中的病毒 RNA。
2.檢體保存:樣本收集後可在4℃ 最多保存72小時,如果將樣品保存在-70℃或更低的溫度下,則可長期保存,提取的核酸 RNA應保存在-70℃或更低的溫度。
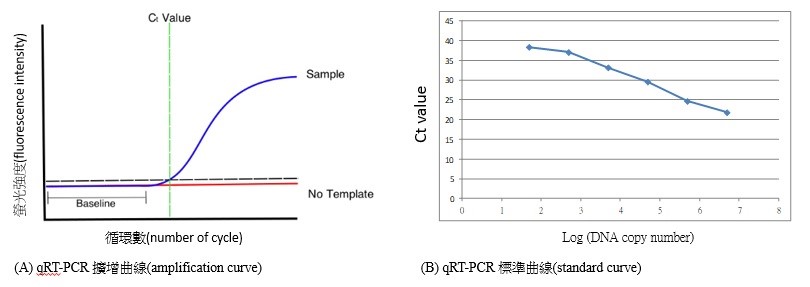
3.分析方法;提取出來的 RNA先以逆轉錄酶(reverse transcriptase)作成互補 DNA(complementary DNA, cDNA),再以螢光染劑偵測每次聚合酶鏈鎖反應(PCR)循環後的產物總量。特點如下;
(1)對PCR反應中的每一個循環的反應產物進行即時檢測,用於檢測PCR產物即時檢測的螢光染料標記在一段可與單鏈PCR產物(模板)專一性雜交的探針(如TaqMan probe)上,並以螢光信號的形式被PCR儀的光學檢測系統記錄下來。
(2)在某一循環中螢光信號的強度達到預先設定的閾值時,此時的循環數稱為Ct(threshold cycle)或Cq值(quantification cycle),Ct值與起始的DNA模板(template)量成反比,起始的核酸量越多,達到閾值的循環數就越少,亦即Ct值會越小。以Ct值為縱坐標,起始模板數為橫坐標作標準曲線圖,可精確計算待測病毒核酸的複製數(copy number)。
在2020 年,多國科學家聯合發表了經過驗證的Coronavirus disease 2019(COVID-19)診斷工作流程(workflow),其設計基於COVID-19與SARS冠狀病毒的密切遺傳相關性,並利用合成qRT-PCR技術分析RNA dependent RNA polymerase(RdRP)基因、外套膜(envelope)基因及核蛋白(nucleocapsid protein)基因,藉由工作流程可靠地檢測到COVID-19,並進一步將2019-nCoV與SARS-CoV區別開來。他們經由學術和公共實驗室之間的協調及合作,確認了297種原始臨床檢體的檢測專一及獨特性,這些原始檢體包含各種人類呼吸道病毒,本研究證明通過國家和歐洲研究網絡中協調學術和公共實驗室可獲得巨大的反應能力。
在2020 年,中國研究人員開發了兩個1步驟(1-step)的qRT-PCR分析法,以檢測病毒基因組的兩個不同區域的開放閱讀框(open reading frame)ORF1b和核蛋白基因。他們設計引物(primer)和探針(probe)來與COVID-19與SARS冠狀病毒進行反應,使用一組陽性和陰性對照以評估這些測定,另測試了兩名2019-nCoV感染患者的呼吸道檢體,結果顯示所建立的方法可以快速檢測檢體中的2019n-CoV,從而早期鑑定COVID-19患者。
●免疫快篩試劑(immunologically rapid screening reagent)
大致可分成兩類,一種是檢測受檢者體內是否有病毒抗體,主要是找出曾受過感染的人,例如登革熱快篩試劑;另一種是檢測體內是否有病毒抗原,主要是找出正受感染的人,例如流行性感冒快篩試劑。COVID-19抗體試劑是一種可辨識血清中2019-nCoV特定蛋白質的(抗原)單株抗體,有潛力作為快篩檢測的關鍵試劑,可在15~20分鐘得知結果。快篩試劑成本較低,未來有潛力像流感快篩試劑一樣,成為第一線醫療人員所使用的檢測工具,不過目前所發表的快篩試劑未正式量產,且準確性及靈敏度未經臨床試驗及確效,亦尚未驗證其呈現偽陰性及偽陽性的比例,仍無法完全取代核酸檢測。在2020年,台灣研究機關研發成果如下:
1.中央研究院研究人員針對7種COVID-19冠狀病毒核蛋白(nucleocapsid protein)抗原,製造出46株毫克等級產量的單株抗體(IgG),其中有1株抗體有極佳的2019-nCoV單一辨識性,不會與SARS、MERS或其它導致一般感冒的冠狀病毒有交叉反應,可望有效判別是否感染2019-nCoV。
2.國家衛生研究院及國防醫學院研究人員延續過去合作研究SARS病毒的成果而開發出一種抗體試劑,因COVID-19和SARS冠狀病毒有相同的抗原部位,因此快速的從SARS抗體庫中篩選出適合者,進而研發出2019-nCoV的快篩試劑。
●結論
COVID-19 近來在全球各地快速流行,迄2020年4月份已造成全世界超過120萬人確診及6 萬人死亡,成為本世紀最嚴重的人類傳染病,在部分國家甚至造成醫療崩潰,而且疫情仍未見緩和,許多國家的疾病黑數仍未完全得知,為迅速隔離可能的患者、爭取治療時間及避免疫情擴大,疾病的篩檢及鑑定極為重要。目前根據接觸史、旅遊史及症狀並結合核酸鑑定的的篩檢方式,雖然十分有效,並具有足夠的準確性及靈敏度,但驗證時效性及便利性略顯不足,故發展快篩試劑投入檢驗是有必要的。最近國內外已有數個研究單位發展出快篩試劑,並計畫與廠商合作試量產,經過臨床試驗並確校後便能實際應用,雖然何時完成效能驗證程序並獲核准仍無法確定,但已開啟了COVID-19快速篩檢及鑑定的一線曙光。
參考資料:
1. Corman VM, Landt O, Kaiser M, Molenkamp R, Meijer A, Chu DKW, Bleicker T, Brünink S, Schneider J, Schmidt ML, Mulders DGJC, Haagmans BL, van der Veer B, van den Brink S, Wijsman L, Goderski G, Romette JL, Ellis J, Zambon M, Peiris M, Goossens H, Reusken C, Koopmans MPG, Drosten C. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 2020 Jan;25(3). doi: 10.2807/1560-7917.ES.2020.25.3.2000045.
2. Chu DKW, Pan Y, Cheng SMS, Hui KPY, Krishnan P, Liu Y, Ng DYM, Wan CKC, Yang P, Wang Q, Peiris M, Poon LLM. Molecular diagnosis of a novel coronavirus (2019-nCoV) causing an outbreak of pneumonia. Clin Chem. 2020 Apr 1;66(4):549-555. doi: 10.1093/clinchem/hvaa029.
3. CDC 2019 novel coronavirus (2019-nCoV) real-time RT-PCR diagnostic panel. Instruction for use. Center for Disease Control and Prevention. Effective: 02/04/2020. https://www.fda.gov/media/134922/download
