【2015諾貝爾生醫獎】阿弗麥克素及青蒿素-對抗寄生蟲疾病的革命性治療法
 撰文|臺大生命科學系范姜文榮編譯
撰文|臺大生命科學系范姜文榮編譯
責編|師大生命科學系李冠群副教授
2015年諾貝爾生理醫學獎桂冠,一半共同頒給坎貝爾 (William C. Campbell)博士與大村智教授(Satoshi Ōmura),因他們發現對抗寄生蟲-線蟲(roundworm)感染的神奇治療法;另一半頒給發現對抗瘧疾神奇治療法的屠呦呦教授。寄生蟲疾病長期讓人類蒙受痛苦,並成為全球主要健康問題。河盲症(River Blindness)最終會導致不可逆的失明。淋巴絲蟲病(Lymphatic Filariasis)會引發慢性腫脹,導致一生外表難看及失能的臨床症狀,如象皮病(Elephantiasis)與陰囊積水(Scrotal Hydrocele)。瘧疾的病源體是單細胞寄生蟲-瘧原蟲(Plasmodium)所引起,藉由瘧蚊叮咬而傳播, -瘧原蟲會入侵紅血球,引起發燒,嚴重會造成腦部發炎而導致死亡。
大體上,這些疾病影響世界上最弱勢的居民,特別是非洲撒哈拉沙漠以南區域、南亞洲、及中南美洲,對改善人類健康與福祉,形成巨大阻礙。2015年諾貝爾生醫獎得主,徹底改變這些會帶來嚴重災難疾病的治療方式。大村智教授從土壤中尋找生物活性物質,以及分離出具顯著特性的微生物-鏈絲菌新品系Streptomyces avermitilis。坎貝爾博士則證實大村智教授所培養微生物具抗寄生蟲活性,並研究該有效物質-「阿弗麥克素(Avermectin)」以對抗家畜或農場動物的各種寄生蟲。現今「阿弗麥克素(Avermectin)」的衍生物「艾弗麥克素(Ivermectin)」,是消滅河盲症與淋巴性絲蟲病的良好治療藥物。屠呦呦教授為了對抗瘧疾,將研究轉移至傳統藥草醫學,自古代文獻探尋治療方式。她發現植物-黃花蒿(Artemisia annua)萃取物能抑制寄生蟲生長;並分離出高效力抗瘧疾活性物質-青蒿素(Artemisinin)。現今以青蒿素為基礎的藥物組合治療(drug combination therapy)已大幅減少瘧疾發生率及死亡率,拯救全世界數百萬生命。坎貝爾、大村智,以及屠呦呦所發現的寄生蟲有效治療方式,對全世界的影響及對人類的效益是無法衡量的。
微生物與寄生蟲 - 健康的主要問題
大量的細菌與寄生蟲對人類有害,甚至致命。醫療社群長期尋找能戰勝細菌感染的新治療方法。Gerhard Domagk因發現磺醯胺(sulfonamides)而獲得1939年諾貝爾獎;Alexander Fleming因發現青黴素(penicillin)、Ernst Chain與Howard Flory因分離出活性成分並證明能有效對抗細菌感染,共同獲得1945年諾貝爾獎。Selman Waksman自土壤分離鏈黴菌(Streptomyces),進而發現能對抗結核病(tuberculosis)的鏈黴素(streptomycin),獲得1952年諾貝爾獎。
相對於細菌感染的新治療方法,很長一段時間,開發對抗寄生蟲病的有效治療法,卻進展有限。許多寄生蟲引起的疾病,如河盲症或淋巴絲蟲病,都沒有暨安全又有效的治療法;且一些其他疾病如瘧疾,已經對傳統藥物產生耐久性及抗藥性,導致難以進行長期的有效治療。過去全世界極力嘗試去發展的新治療法,若不是效果有限,就是會產生副作用,直到2015年三位諾貝爾獎得主的發現,才戲劇性地改變這種情況。
寄生蟲疾病與全球健康的影響
寄生蟲(parasites)是指棲息在其他生物體(宿主,host)體內或體表的生物體。宿主是它們獲取養分和繁殖的場所,常會導致宿主出現慢性或致命的疾病。有三類主要的寄生蟲會對人類引發疾病,即原生動物(protozoa)、蠕蟲(helminthes)和外寄生蟲(ectoparasites)。寄生蟲長久以來令人類遭受痛苦,並造成全球健康問題。寄生蟲特別容易影響世界上最弱勢的居民,造成改善健康與福祉的巨大障礙(圖1)。許多寄生蟲也攻擊家畜與家禽,產生額外的社會負擔。每年受寄生蟲感染的病患數相當驚人,全世界有數億兒童與成人受到影響。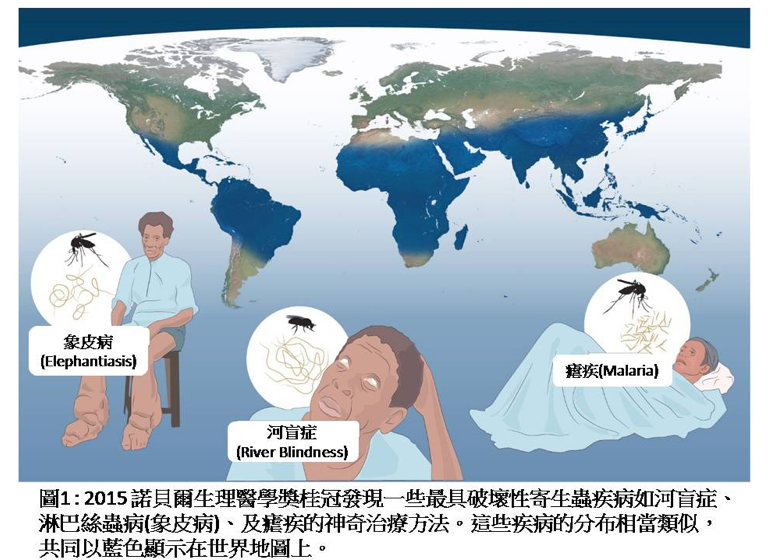
阿弗麥克素的發現 : 對抗寄生蟲的治療法
腸線蟲
全世界有超過10億人受到一種或多種的腸線蟲(Intestinal Nematodes)感染。這些疾病阻礙經濟成長,並不成比例地影響貧民,造成經濟的主要負擔,被認為是受到漠視社區與居民的疾病。
腸線蟲,如蛔蟲(ascaris)、腸蟲(ancylostoma)、鞭蟲(trichiuria)、絲狀蟲(filaria)、蟠尾絲蟲(onchocerca)、腸擬圓蟲(strongyloides)、及羅阿絲狀蟲(loa loa),都是線蟲(roundworms)。它們的長度從1 mm至成熟時數公分,生活史複雜且差異大。有些線蟲可以從這個人傳播至另一個人,但大多需要中間宿主(intermittent host)來傳播。因蠕蟲(helminth parasites)大多無法自我增殖,需要重複接觸寄生蟲,因此其臨床症狀通常只發生在長期居住於特定區域。
河盲症(蟠尾絲蟲病)
蟠尾絲蟲病(Onchocerciasis),一般稱作河盲症(River Blindness),是絲蟲(filarial worm) Onchocerca volvulus感染所引起。該疾病僅傳染給人類,當雌性黑蠅(blackfly)將絲蟲的三期幼蟲植入宿主皮膚傷口,這些幼蟲在宿主皮下組織增殖為結節(nodule),發育成熟至成蟲。O. volvulus雌性成蟲大小大約是雄性成蟲的兩倍,體長33~50cm、寬270~400μm,成蟲能存活18年。在宿主體內交配後,雌性成蟲能每天釋放高達1000隻小絲蟲(microfilariae),接著再移動至全身,引發各種症狀,如慢性皮膚炎(chronic dermatitis)、皮膚疹(skin rashes)、皮膚病變(lesions)、劇烈發癢(intense itching)、以及皮膚脫色(skin depigmentation)。當小型絲蟲抵達眼睛,會引起眼睛發炎、角膜結疤,最終導致失明。河盲症是世界上失明的第二主要感染原因,因河川附近黑蠅數量特別多,故命名為河盲症。河盲症大多發生在非洲撒哈拉沙漠以南區域、南亞洲、及中南美洲,使世界上許多最弱勢的地區居民遭受痛苦,估計約2500萬人受到感染,超過30萬人造成失明。2016年以前,在31個特定國家,感染河盲症風險的總人數達到約2億5千萬人。
淋巴絲蟲病
淋巴絲蟲病(Lymphatic Filariasis),是淋巴系統受到線蟲-絲蟲屬(family Filariodidea)(如潘氏絲狀蟲Wuchereria bancrofti、馬來血絲蟲Brugia malayi、帝汶絲蟲Brugia timori)寄生蟲感染所引起。絲線蟲(Filarial nematodes)需要人和蚊子兩種宿主才能完成生活史,蚊子是中間宿主,人類是最終宿主。絲蟲屬的雌性線蟲體型較雄性線蟲大。馬來血絲蟲體型比潘氏絲狀蟲小,成熟雌性體長43~55mm,寬130~170μm。受精後的雌性線蟲釋放小線蟲,體長177~230μm、寬5~7μm,可存活3~36個月。大線蟲(microfilariae)一般可存活5~7年,棲息在人體淋巴系統;小線蟲會夜行性遷移,白天在深部靜脈(deep vein),晚上在週邊循環系統。小線蟲在蚊子腸道,經數個時期發育成感染性幼蟲(infectious larvae),當下一個宿主受到叮咬,就傳染至新宿主體內,繼續下一個生活史。人體內線蟲數量隨時間增加,會產生嚴重的慢性發炎症狀。淋巴絲蟲病影響超過1億2千萬人,它造成淋巴管阻塞、慢性腫脹,導致終身不雅及失能的臨床症狀,如象皮病(Elephantiasis)及陰囊積水(Scrotal hydrocele)。
發現特殊抗菌特性的微生物
大村智是微生物學家,他曾在日本北里研究所工作,在天然物分離有非常好的研究成果。1971年,大村智教授前往美國衛斯理大學(Wesleyan University)的Max Tishler實驗室,擔任訪問研究科學家。Tishler是Merck藥廠Shape and Dome研究實驗室(簡稱MDRL)的前主任,是大村智教授與該實驗室舉行共同會議的促成者。他對抗生素一直很有興趣,可追朔至第一個抗生素的發現。1972年,Merck藥廠的首席微生物學家H. Boyd Woodruff前往日本北里研究所與大村智教授建立合作關係,針對微生物發酵,研究開發新的抗微生物物質。Tishler與Woodruff都曾與Selman Waksman共事。
大村智教授聚焦土壤中能產生抗菌物質的一群鏈黴菌(Streptomyces),過去,Selman Waksman曾經從鏈黴菌中發現鏈黴素(Streptomycin),但長久以來,由於鏈黴菌很難在實驗室培養,導致不容易發現新品系的鏈黴菌。後來大村智教授藉由獨特方法大規模培養這些細菌,然後分離出土壤中的鏈黴菌新品系,並在實驗室成功培養它們(圖2)。大村智教授從數千個鏈黴菌培養液中,選取約50個最有希望的培養液,生產神奇的二次代謝物,目的是進一步分析抗菌活性(antimicrobial activities)。在日本伊豆地區高爾夫球場附近找到的鏈黴菌新品系之一,後來發現是能產生「阿弗麥克素(Avermectin)」的鏈黴菌Streptomyces avermitilis,該品系後來被稱作Streptomyces avermectinius。
發現阿弗麥克素的抗寄生蟲活性及有效物質的特性
William C. Campbell是寄生蟲生物學專家,曾工作於Merck藥廠MDRL實驗室,透過與北里研究所的合作協議,獲得大村智教授所培養菌液及研究其效力。凍乾後的菌液被混在食物中,藉由受寄生蟲感染小鼠,檢驗是否寄生蟲會減少。發現有一菌液,受線蟲(Nematospiroides dubius)感染小鼠,儘管幾近死亡,但寄生蟲有減少現象。該結果促使大村智教授精製培養菌液,以便在製備過程去除寡黴素(oligomycin)的毒性汙染。與Campbell緊密合作的Thomas W. Miller,對菌液有效成分加以分析,發現有效成分是「阿弗麥克素(Avermectin)」。Campbell接著確認該成分具抗寄生蟲活性,並證實該活性對家畜或農場動物的各種寄生蟲也都具有活性(圖3)。接著大村智教授應用分子生物學、化學、及微生物學等多種技術,決定該生物體的分類地位;後來根據所建立的基因體序列及遺傳學研究,提出Streptomyces avermectinius的命名。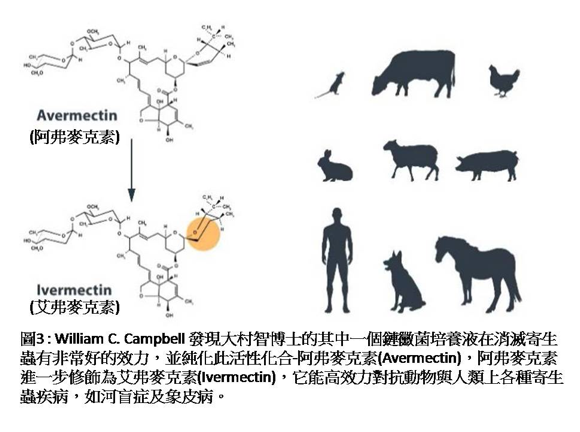
從阿弗麥克素到艾弗麥克素及其臨床效果
Campbell與Merck藥廠MDRL實驗室的同事,之後共同將「阿弗麥克素(Avermectin)」經由化學方法改變結構為「艾弗麥克素(Ivermectin)」,它能更有效地對抗寄生蟲感染。「艾弗麥克素」是由2個氫化作用修飾「阿弗麥克素」的半合成型式(semisynthetic version)。因此,Campbell啟動研究團隊去確認「艾弗麥克素」分子的五項特性:(1)所具特殊潛能;(2)在各種宿主,對抗許多線蟲的活性;(3)對抗腸道以外寄生蟲,如棲息於血液中的小絲蟲,具長期持久的活性;(4)對抗苯并咪唑(benzimidazole)抗藥性線蟲,具有活性;(5)對宿主具良好耐受性,有良好的用藥安全界限。受動物實驗正面結果啟發,特別是狗心絲蟲減少的結果,讓Campbell於1977年認為「阿弗麥克素」類之藥物,能測試河盲症寄生蟲感染的人類。1981~1982年,Merck藥廠MDRL實驗室的河盲症專家Mohammed Aziz博士,首次在人類成功試驗。結果清楚顯示 : 給予病患「艾弗麥克素」單一劑量,當一段時間未接觸到成體絲蟲,能完全除去或幾乎除去小絲蟲。潘氏絲狀蟲(Wuchereria bancrofti)會引起淋巴絲蟲病(lymphatic filariasis),給予受感染病患「艾弗麥克素」單一劑量處理後,能有效清除血液內小絲蟲。
「艾弗麥克素」的作用模式目前仍未十分瞭解,但與開口型麩胺酸鹽氯離子通道(glutamate-gated chloride ion channels)、無脊椎動物肌肉的活化γ-胺基丁酸氯離子通道(GABA-activated chloride channels)之抑制,以及小線蟲神經細胞有關聯。該抑制會增加細胞膜對氯離子通透性,造成細胞膜過極化,導致寄生蟲肌肉麻痺及死亡。該效果造成寄生蟲慢性死亡、減少宿主發炎反應、及緩和疾病的臨床症狀。這些專一性受器,出現在線蟲、昆蟲、及蛛形綱動物,但未出現在絛蟲與吸蟲。這些開口型配體(ligand-gated)氯離子通道,也部分表現在哺乳動物的中樞神經系統,但它們親和性低,且受到血腦障壁(blood-brain barrier)保護。因此,「艾弗麥克素」,其低濃度未傷及宿主,就能殺死寄生蟲,屬高選擇性藥物。
現今,「艾弗麥克素」藥劑被認為是高效力治療法,僅需一年服用1~2次。因此即使世界上最偏遠地區的居民也能使用該療法,這功勞應歸功於Merck藥廠總裁(CEO)Roy Vagelos博士,因他將該藥廠符合品質的「艾弗麥克素」藥劑,無償提供給各國政府及需要治療河盲症及淋巴絲蟲病的患者。另外,消滅河盲症及象皮症,也被世界衛生組織(WHO)列為減少受漠視熱帶疾病區域性策略的重要目標。
根據WHO報告,2012年當時,已有超過2億人接受「艾弗麥克素」為期1~25年的治療。為了減少淋巴絲蟲病患,已有1億1千8百萬人接受「艾弗麥克素」及「胺基甲酸甲酯(albendazole)」為期1~11年的治療。2013年,WHO提出2020年淋巴絲蟲病、2025年蟠尾絲蟲病,能達到絕跡的全球目標。大村智教授及Campbell博士共同努力的卓越貢獻,證實新發現的藥劑能極有效對抗寄生蟲。
瘧疾 : 全球威脅
早在西元前2000年,埃及與希臘早期、以及中國古代文獻,就有記載瘧疾是接觸傳染性疾病。瘧疾長久以來一直影響人類的生存,對人類基因體產生演化壓力,如不同族群有演化出不同的基因保護型式。例如,鐮形血球貧血症(Sickle-cell Disease)及地中海型貧血(Thalassemia),兩種先天性血液機能失常貧血者,較常被發現分佈於瘧疾高發生率區。「瘧疾(malaria)」名稱衍生於中世紀的義大利語,意旨「不潔的空氣」,起源於古羅馬人認為瘧疾來自沼澤的刺激性氣體。瘧疾是由單細胞寄生蟲-瘧原蟲(Plasmodium)所引起。有5種瘧原蟲能感染人類,導致發抖、發熱、及冒汗的週期性症狀。較嚴重的腦病變-腦部瘧疾以及死亡,通常是由鐮狀瘧原蟲(Plasmodium falciparum)所引起,而其它瘧原蟲引起的症狀通常較溫和。瘧疾是藉由瘧蚊(Anophele)傳播,當受瘧疾感染的雌性瘧蚊叮咬人類,它會將瘧原蟲孢子體(sporozoite)引入至血液中。該瘧原蟲孢子體會入侵肝細胞處,產生數千個能無性生殖的裂體性芽孢(merozoites),導致肝細胞破裂,裂體性芽孢被釋放至血液,被感染紅血球受到破壞,再釋放許多裂體性芽孢,去感染其它的正常紅血球。另外,寄生蟲的有性繁殖,則藉由吸血瘧蚊叮咬達成,以繼續它的生活史。
根據WHO 2014年全球瘧疾報告,每年約有34億人面臨瘧疾感染風險。僅2013年,全球就有1億9千8百萬瘧疾感染病例,並導致58萬4千人死亡。瘧疾病患90%死亡發生於非洲,其負擔最為沉重,其中年齡未滿5歲的兒童占死亡人數的78%。
發現青蒿素的抗瘧疾活性
瘧疾的嚴重衝擊,刺激科學家在過去百年密集地努力研究,產生一系列的諾貝爾生理醫學獎得主。在印度工作的英國陸軍外科醫生Ronald Ross,因發現瘧疾是藉由蚊子傳播,獲得1902年諾貝爾獎。在阿爾及利亞當地醫院工作的法國醫生Charles Laveran,因發現感染瘧疾病患的紅血球存在寄生蟲,獲得1907年諾貝爾獎;他也證實奎寧(quinine)治療能清除血液內寄生蟲。瑞士化學家Paul Herman Müller因發現DDT對許多節肢動物如蚊子是接觸性毒物,獲得1948年諾貝爾獎。不久之後,高效力殺蟲劑DDT就被廣泛使用在消滅蚊子,希望減少寄生蟲在個體間傳播。當時隨著新開發的抗瘧疾藥劑-氯化奎寧(chloroquine)的出現,最初其治療方式有效地減少許多國家的瘧疾發生率,但僅經過幾十年,蚊子就對DDT產生抗藥性,人們也嚴重關切DDT殺蟲劑對環境造成的衝擊。鐮狀瘧原蟲抗藥性品系的出現及擴散,使人懷疑氯化奎寧的抗瘧耐久性,這些因素導致1960年代瘧疾死亡率上升及擴散。
當時,瘧疾發生率不斷上升,屠呦呦的研究團隊戮力發展瘧疾新療法,她將研究重心轉移至傳統中國醫學,探索數千年來治療發燒的處方。屠博士的研究團隊發現植物-黃花蒿(Artemesia annua;sweet wormwood),不同於其他植物,在數百種處方出現。她們最初進行青蒿萃取物測試時,發現它能實質抑制囓齒目動物的瘧疾寄生蟲感染(圖4)。但青蒿的活性卻並不一致,後續實驗發現有12~40%的抑制變異。因此屠博士再度查閱古代文獻及研究葛洪於西元340年的處方,她發現文獻紀錄是使用冷水,而非傳統使用沸水,去萃取青蒿葉片汁液。這啟發她使用乙醚作為替代的冷萃取步驟,而非使用乙醇萃取;經使用此低溫萃取程序,獲得100%殺死受感染小鼠及猴子瘧疾寄生蟲的一致性結果。青蒿素(Artemisinin)的重大發現,是對抗瘧疾的轉捩點。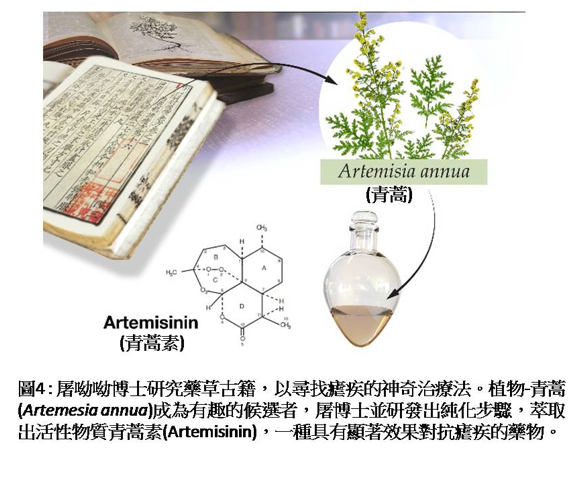
青蒿素對抗瘧疾的臨床效果
受這些實驗發現的鼓舞,屠呦呦經臨床測試後發現,青蒿萃取物能快速降低發燒,以及降低瘧疾病患血液內寄生蟲數目。受此臨床結果鼓舞,激勵屠呦呦團隊進一步研究,去分離萃取物的活性成分,該成分後來被稱作青蒿素(Artemisinin),並建立其化學結構式。青蒿素是抗瘧疾的代表性新藥劑,當紅血球受到感染,初期就能破壞瘧疾寄生蟲。雖然它的作用機制目前仍然不是完全瞭解,但證據顯示可能與蛋白質Kelch 13有關。有研究顯示蛋白質Kelch 13的突變與延緩寄生蟲清除有關,被認為是世界上一些地區出現青蒿素抗藥性的原因。為了對抗在南亞,而不是在非洲的青蒿素抗藥性,WHO建議青蒿素結合其它抗瘧疾藥物的治療方式。
ACT,一個結合殺蟲劑處理的防蚊網與室內噴灑殺蟲劑的病媒防治法,已經戲劇性減少瘧疾死亡率, 2000~2013年間全球減少高達47%,非洲則高達54%。同一時期,受瘧疾感染病例數下降26%,自1億7千3百萬下降至1億2千8百萬病例。2~10歲兒童,平均瘧疾感染盛行率(prevalence),自26%下降至14%。現今,ACT病媒防治法已大幅減少瘧疾發生率,拯救全世界數百萬人的生命。
屠呦呦所發現的青蒿素,是新類型抗瘧疾的代表性藥劑,能在瘧疾發生初期就殺死瘧疾寄生蟲,顯示青蒿素具極佳潛能,去治療嚴重的瘧疾。
阿弗麥克素及青蒿素的治療法–造福人類
阿弗麥克素及青蒿素的發現,深遠地改變寄生蟲疾病的治療方式,這些疾病主要影響居住在社會邊緣區域、最脆弱的居民。僅瘧疾就造成每年50萬人的死亡,90%發生在非洲,且令人悲傷地,80%是不到5歲的兒童。
以青蒿素為基礎的治療法,能顯著減少瘧疾死亡率,特別是罹患嚴重瘧疾的兒童(>30%)。根據WHO 2015年報告,近15年來,瘧疾全球總死亡人數已下降50%。
線蟲感染經常發生於兒童時期,且造成終身痛苦及失能。線蟲引起的多種疾病,以河盲症與淋巴絲蟲病最為嚴重,分別有高達2千5百萬人及1億2千萬人罹患。這些疾病屬受漠視的熱帶疾病,造成「失能調整後存活年(disability adjusted life-years ;DALYs)」每年總損失高達約4千6百萬至5千7百萬年。因此,這些疾病是造成疾病及失能的最顯著全球性原因。非洲約占這些疾病全球健康及經濟負擔的一半。現今,寄生蟲疾病的有效治療方法,能藉由服用「艾弗麥克素」每年1次或2次劑量解決。因此,在寄生蟲分別攻擊人類眼睛及淋巴系統之前,「艾弗麥克素」就能有效消滅這些寄生蟲,避免造成失能。因其作用方式,「艾弗麥克素」也已被視為預防性藥劑。
「阿弗麥克素」及「青蒿素」的治療法,對全球的影響遠遠超過個人疾病負擔的減少。因這些寄生蟲疾病會產生龐大的疾病負擔,不成比例地影響貧困及脆弱的居民。特別是受感染者,一生承受疾病負擔,被剝奪接受教育及學習必要技術的機會,影響支撐個人及家人的生活,進一步壓迫及迫使他們貧窮一生。這些疾病不僅導致慢性疾病,也與身體及心理的失能有關,阻礙個人整體健康、福祉、及生計。
經過持續努力地減少這些疾病的傳播,現在河盲症與淋巴絲蟲病,正處於被消滅的邊緣。由世界衛生組織(WHO)、非政府組織(NGOs)、以及各國政府所發起的全球行動,提出2025年前消滅河盲症及2020年前消滅淋巴絲蟲病的目標。一些國家先前遭受瘧疾侵襲,現在當地也已免除瘧疾傳播。
2015諾貝爾生理醫學獎得主的發現,代表醫學典範的轉移,它不僅提供革命性的治療方式,使病患免於遭受毀滅性寄生蟲疾病,也促進個人及社會的健康與繁榮。他們的發現對全世界的影響及對人類的效益是無法衡量的。
