【關於 COVID-19 的這大半年】咆問疫從何處來
 撰文/駱宛琳
撰文/駱宛琳
打從疫情一開始,關乎「疫情從哪來」的流言蜚語就沒有停歇過。
流行病學家 Adam Kucharski 博士任教於 London School of Hygiene and Tropical Medicine,在新書 The Rules of Contagion 裡,討論疾病(甚至是假消息),是如何爆發,又如何終了的。他開始寫書的時候,正值聖誕節;沒想到新年一過,這出書的計畫,倒是讓人苦笑不已的無巧不成章。
在疫情裡,我們都想知道這事是如何開端地; 好像有了萬夫所指的責備對象以後,就可以避開這次橫禍,或者,就能安保未來無憂了。但,大多數的事情,都不若點火燎原,更不是排排站的骨牌,只要挪掉了第一枚骨牌、不讓它傾倒,就能確保後頭骨牌的安然。
不過,即便「疫從哪裡來」的探問究查,無法保證我們免於下一場全球大流行的到來,卻能夠在為未來提供覽古戒今的素材之餘,更幫助我們好好地應對當下疫情。對流行病源頭的追查深究,對於疫情的遏阻管控,扮演了關鍵角色。而這所謂的「源頭」,包括了導致疫情的「病原體」,以及如何從最初宿主傳染至人的「傳染途徑與傳染媒介」。倘若能在疫情爆發初始之際,「迅速地」將這些關鍵要項釐清,就能夠讓相關防疫單位,能夠對症下藥地精準制定防疫策略。
「速度」正是一個重點。這是疫情發展在未受控制下,常以指數型生長(exponential growth)的態勢蔓延。指數型增長有多恐怖呢?我最喜歡的具象描述,是 Radiolab 在三月底 Podcast 裡所舉出的例子。如果,今天給你一百萬元,又或者是,今天給你一分錢(cent;也叫做 penny),明天給你兩分錢,後天給你四分錢,如此每天翻倍地給你一個月。你會選擇哪一種呢? 如果你選擇後者,到月底的時候,大概會接近二千萬呢!又或者,換一個說法,如果以 Podcast 主持人三公尺見方的小小辦公室為例,如果每天都把這空間擴增一倍,只需要一個半月左右的時間,不斷倍增的辦公室佔地面積,就會比地球表面還大。以指數型速度蔓延的疫情,絕不單單是「擴散很快」能夠形容的。
「防疫要即早」的策略,在將近二十年前的禽流感 H5N1 與 SARS 疫情,都有良好成效。到 2009 後,快速地病原體基因體分析,更已是疫情爆發時的標準應對步驟。不論是 2012 年中東呼吸症候群冠狀病毒、2013 年 H7N9 禽流感病毒、2014 年伊波拉病毒、或是 2015 年茲卡病毒,神速地利用定序技術與基因體分析,都讓我們在防疫上佔得先機。
仰仗著基因定序技術的發達,這一次在疫情爆發之後,科學家依舊很快地驗明了 COVID-19 全球大流行的始作俑者。世界衛生組織也將這正身,正名為SARS-CoV-2 病毒。可惜,相應的後續措施,在如今事後諸葛的上帝視角來看,卻不盡如人願。
SARS-CoV-2 雖新,其所身屬的冠狀病毒科(Coronaviridae)在人類史上可是出沒已久。與其有關的研究,甚至可以追溯到 1930 年代。除了SARS-CoV-2,同樣致命地還有 SARS-CoV(嚴重急性呼吸症候群冠狀病毒)、以及 MERS-CoV(中東呼吸症候群冠狀病毒),分別在 2002 與 2012 的時候禍患於世。另外還有四種冠狀病毒可以感染人類,包括了 HKU1、NL63、OC43、還有229E ,但這幾種病毒比較小咖,感染後的症狀相較前面三種,要輕微許多。
在驗明 SARS-CoV-2 正身之後,藉由對病毒序列的分析與科學研究,自是可以對 SARS-CoV-2 的危害手段與身家底細,詳加盤查。四月時,於美國加州 Scripps Research Institute 專門研究宿主與微生物之間複雜關係的 Kristian Anderson 教授,便與多位專家一同在 Nature Medicine 上,概括分析了 SARS-CoV-2 的病毒序列特性,並對感染源頭的幾個主要可能性,簡要整理了一番。自此,相關的研究如雨後春筍般,一篇接著一篇。其中,有一篇橫跨美國、比利時、與英國等研究團隊,在 Nature Microbiology 上所發表的成果,更是備受矚目。我們一起來看看,至今,我們對 SARS-CoV-2 的了解,有多少吧。
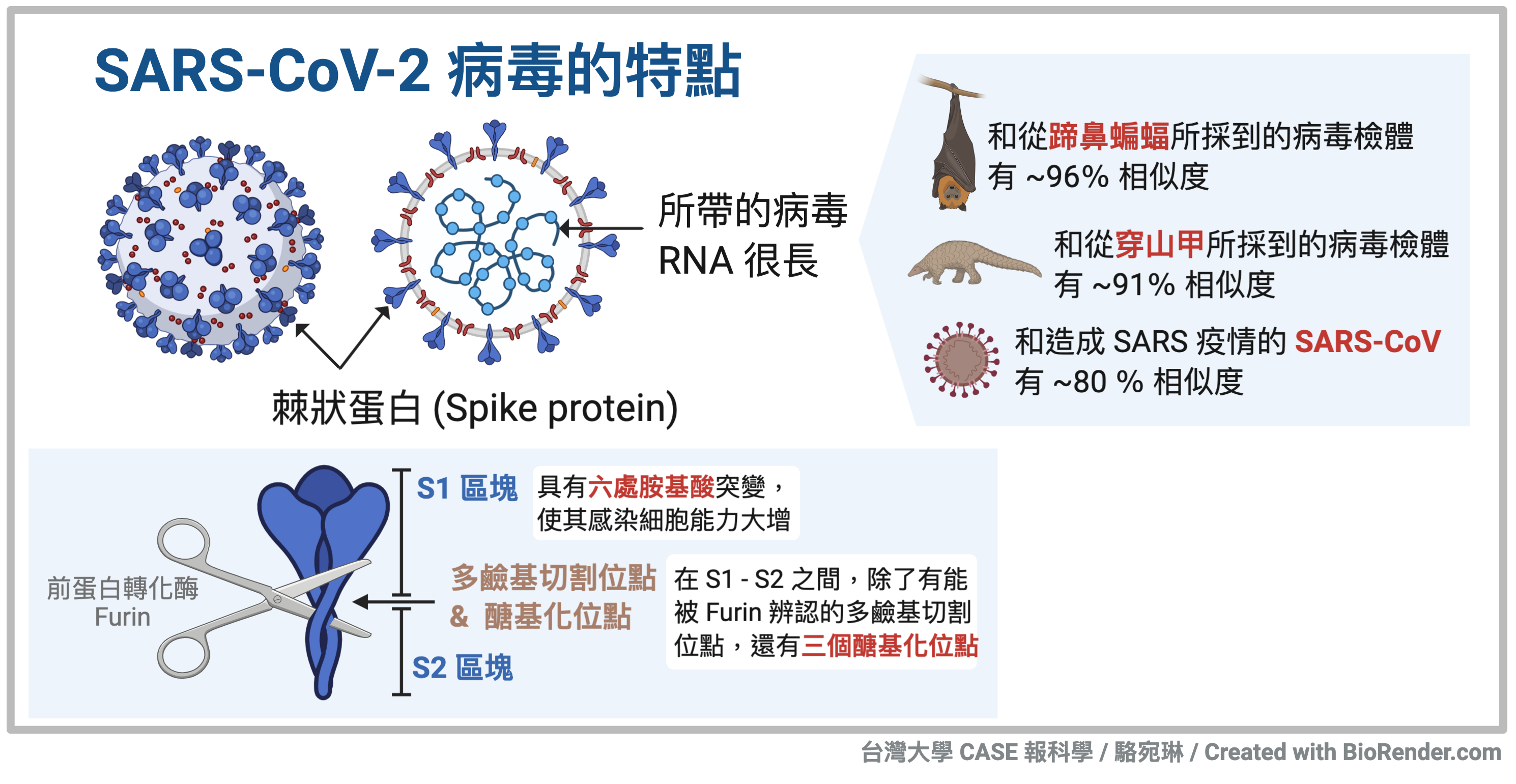
首先,先來看看這病原體本身。SARS-CoV-2 既然身屬於冠狀病毒裡的一份子,目前研究也證實,它也不可免俗地有著其他冠狀病毒一般的特色。除了外觀像皇冠而得名,其所帶有的基因組,是一條長達 30 kb 的單股 RNA,是已知 RNA 病毒裡最為可觀的。一般流感病毒的基因組,只有約 14 kb 左右。
接續的研究很快地發現SARS-CoV-2 有別於 SARS-CoV、或是其他種冠狀病毒的獨特之處。首先,讓人咬牙的是,SARS-CoV-2 在結構上,似乎特別擅於結合上人類細胞受器 ACE2。再來,這病毒表面的棘狀蛋白(spike protein)序列裡,多嵌入了一段十二個核苷酸長的片段。而這兩大特性,除了讓科學家能夠循線追查 SARS-CoV-2 的身家底細是從哪裡演化出來的,也讓我們有跡可循為什麼 SARS-CoV-2 如此致命難纏,甚至提供研發新藥的著眼點。
我們先來討論 SARS-CoV-2 打從哪裡來。
一但定序了 SARS-CoV-2,就像採集到了罪犯指紋一樣。只要資料庫夠詳盡,經過比對,不難挖出底細。SARS-CoV-2 和早年的 SARS-CoV 病毒,有大約百分之八十的序列相似度。不過,目前發現序列最相近的,是在中國雲南省蹄鼻蝙蝠(horseshoe bat;Rhinolophus affinis)上所採樣而得的檢體,相似度高達百分之九十六。但,百分之九十六的相似度雖夠高,卻仍不盡如人意;所以,科學家還在努力尋找中間所缺失的連結,是落在哪裡。
而 SARS-CoV-2 借道於 ACE2 這個表面蛋白質來感染細胞,這策略並非創世新奇。其姐妹 SARS-CoV 雖然只有八成相似度,但也是利用同樣的細胞表面蛋白質。不過,SARS-CoV-2 棘狀蛋白上的六個突變胺基酸,讓它比其他種也利用 ACE2 來感染宿主細胞的冠狀病毒,更擅長結合 ACE2。
棘狀蛋白專職於結合上宿主細胞表面的受器,可謂冠狀病毒能夠感染細胞的第一步。而棘狀蛋白既頂著衝鋒的重責,也身擔冠狀病毒的「顏值」——棘狀蛋白裡受器結合域(receptor-binding domain)是冠狀病毒基因組裡變異最大的區段。不同的冠狀病毒,表現不同的棘狀蛋白,故而提供了探查病毒身家底細的切入點。
以 SARS-CoV-2 來說,這六個胺基酸的變異,和蹄鼻蝙蝠所採樣到的病毒檢體(RaTG13)也不一樣,這故而讓科學家傾向於從蝙蝠到人類之間,不是 RaTG13 此病毒,可以如魚躍龍門一樣一飛沖天,屁股扭扭就能夠變成 SARS-CoV-2 此等殺手級病毒這般簡單。這中間必然還有無數次的天擇演化,悄悄發生著。
於是,這有幾種可能,一種是在 SARS-CoV-2 在變得能夠人畜共通傳染之前,還有一個在蝙蝠之後的中間宿主。讓科學家心生起疑的可能中間宿主之一,是馬來穿山甲(Malayan pangolins;Manis javanica)。從採樣自走私到廣東省的馬來穿山甲檢體裡,有發現相似度極高的冠狀病毒(但序列相似度只有百分之九十一左右)。但馬來穿山甲之所以嫌疑高,是因為在分析檢體裡的冠狀病毒基因組序列之後,發現其棘狀蛋白裡受器結合域,恰恰好帶有 SARS-CoV-2 那六個胺基酸變異。
不過,之前提過,除了這六個位於棘狀蛋白裡受器結合域的胺基酸變異,SARS-CoV-2 的另一個特點,是在棘狀蛋白裡有一小段的嵌入序列突變。這小段嵌入序列之所以特別,是因為它剛剛好介於棘狀蛋白 S1 與 S2 之間。棘狀蛋白既然像皇冠上的突起,可以把這蛋白想像成皇冠突起的「支撐座」和「鑲於其上的珠寶」。棘狀蛋白裡的 S2 像是那支撐座,S1則像那珠寶。而那小段的嵌入突變,正位在S1 與 S2 這兩個功能區塊之間,並且提供了三處可能的醣基化點。這醣基化點,像是在基座與珠寶之間,還虛榮地錦上添花了三串流蘇吊穗。而不論是蝙蝠還是穿山甲所採到的病毒檢體裡,都不具有這錦上添花。
另一種可能,是這天擇過程,發生病毒能夠人畜傳染之後。換言之,SARS-CoV-2 是在人類身上,逐漸變得愈來愈適應,愈來愈能夠人傳人。在最早的研究裡,在分析從 COVID-19 病人身上所分離出來的病毒之後,推估最近的共用始源病毒,最早可能是在去年十一月底、十二月初出現。如果這假設為真,那在 SARS-CoV-2 能夠有效地人傳人之前,或許就有些病毒感染人的零星案例,但因為傳染鏈太短,才不被察之。這也會很像 MERS-CoV 的例子。早期的時候,幾乎所有的人類罹病案例,都是個自由駱駝身上而被感染。
你說,有第三種可能,是人為嗎?目前,科學上的證據其實並不支持這個可能。若要人為,一則是有人蓄意製造,二是從實驗室裡被大意流出。SARS-CoV-2 不會是人為的科學證據,幾乎已經可以說是鐵證歷歷。首先,目前我們手上最相近的序列,是從蹄鼻蝙蝠所採樣到的病毒檢體,而我們已經討論過為什麼這組序列不會是罪魁禍首。而且,經過電腦分析發現,如果要人為的話,SARS-CoV-2 上的那六個特異性胺基酸,並不是透過生物資訊分析會得到的最佳解。換言之,如果真有人想要扮演上帝,將蹄鼻蝙蝠所採樣到的病毒檢體大為改造,那六個胺基酸變異,不會是人類知識可及下能想到的首選。而且,記得那錦上添花的「醣基化」嵌入變異嗎?通常,這種特色,也不會是人工一代又一代細胞養殖所能篩選出來的特色,而通常是和免疫系統互動才有呢。如果想要更近一步了解的人,也可以參考幾位病毒學家,聯手在 Emerging Microbes & Infections 更進一步的討論(參考資料 #6)。又或者是 Podcast 〈This Week in Virology〉在第 623 集裡的後段,Peter Daszak 也有跟主持的幾位病毒學家討論到喔。
討論到的原始研究:
關於 SARS-CoV-2 病毒起源:Maciej F Boni, Philippe Lemey, Xiaowei Jiang, Tommy Tsan-Yuk Lam, Blair W Perry, Todd A Castoe, Andrew Rambaut, David L Robertson. Nat Microbiol. Evolutionary origins of the SARS-CoV-2 sarbecovirus lineage responsible for the COVID-19 pandemic. 2020 Jul 28. doi: 10.1038/s41564-020-0771-4. Online ahead of print.
關於 SARS-CoV-2 病毒的幾個特點:Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF. The proximal origin of SARS-CoV-2. Nat Med. 2020 Apr;26(4):450-452. doi: 10.1038/s41591-020-0820-9. PMID: 32284615
參考資料:
- Timothy Sheahan et al. Mechanisms of zoonotic severe acute respiratory syndrome coronavirus host range expansion in human airway epithelium. J Virol. 2008 Mar;82(5):2274-85. doi: 10.1128/JVI.02041-07. Epub 2007 Dec 19.
- Canrong Wu, et al. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods Acta Pharm Sin B. 2020 May; 10(5): 766–788. Published online 2020 Feb 27.
- Wendong Li, et al. Bats are natural reservoirs of SARS-like coronaviruses. Science. 2005 Oct 28;310(5748):676-9. doi: 10.1126/science.1118391. Epub 2005 Sep 29.
- Weiss SR. Forty years with coronaviruses. J Exp Med. 2020 May 4;217(5):e20200537. doi: 10.1084/jem.20200537.
- Juan Ángel, et al. Recombination and lineage-specific mutations led to the emergence of SARS-CoV-2. bioRxiv. 2020 Mar 23;2020.02.10.942748. doi: 10.1101/2020.02.10.942748. Preprint
- Shan-Lu Liu, et al. No credible evidence supporting claims of the laboratory engineering of SARS-CoV-2. 2020 Feb 26;9(1):505-507. doi: 10.1080/22221751.2020.1733440. eCollection 2020.
- Podcast <This Week in Virology> #623. Bats and coronaviruses with Peter Daszak.
- Podcast <Radiolab> Dispatch 1: Numbers.
- Adam Kucharski. <The Rules of Contagion: Why Things Spread - and Why They Stop> Wellcome Collection.
