賈法尼電池
賈法尼電池(Galvanic Cell)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
賈法尼電池(Galvanic Cell),將自發性氧化還原化反應產生的化學能轉換成電能用以做功的裝置,例如鋅銅電池。(圖一)又稱作伏打電池(Voltaic cell,注意不是伏打電堆voltaic pile),是電化電池(Electrochemical cell)的一種。
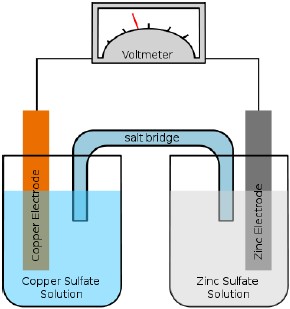
賈法尼電池包含兩個半電池,每一個半電池由金屬和其金屬鹽類溶液組成,兩個半電池可由一鹽橋(Salt brigde)連通之(圖一),或由一可以讓特定離子通過的半透膜或多孔性材質隔開(圖二)。金屬分別充作陽極(Cathode)以及陰極 (Anode),和鹽類溶液的金屬離子分屬不同氧化態,以供氧化或還原反應進行;鹽橋則是一充滿電解質溶液的管道。當兩電極以電線相連時,氧化反應開始進 行同時產生電動勢(Electromotive force)電流。在國中、高中課本當中所見的鋅銅電池(Daniell cell),即是一個典型的賈法尼電池。其正極與負極分別是銅與鋅,又分別對應陰極與陽極。而同時,陰極所使用的電解液為硫酸銅,陽極則為硫酸鋅,其中以 硝酸鉀溶液作為鹽橋。
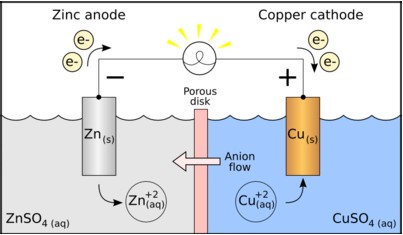
而此電池在陰極會發生還原反應,而在陽極則發生氧化反應。半反應式可寫如下二式:
Cu2+(aq) + 2 e- → Cu(s)
Zn(s) → Zn2+(aq) + 2 e-
而全反應式就可以寫為:
Cu2+(aq) + Zn(s) →Zn2+(aq) + Cu(s)
可以看到,在陰極溶液當中硫酸銅的銅離子,會得到電子還原成銅,並附著在陰極的銅棒上。如此一來,銅離子的濃度就會逐漸下降。反之,在陽極,電極上的鋅則會脫落進入溶液中,使得其中鋅離子的濃度逐漸上升。
而這其中的電荷平衡,則由鹽橋來負責;例如當某一部份的溶液傾向於正電荷較多,那麼鹽橋的陰離子就會因為電磁吸引力而前往之,反之陽離子則會遠離之。不過這個離子的移動速度相當快,因此並不會真的有正電荷或負電荷較多的情形。此外鹽橋所使用的離子不參與反應。
在整個鋅銅電池反應開始之前,其電動勢除了由選用的金屬本身決定之外,另外一個則是兩電解質溶液的濃度。金屬本身就會具有其氧化與還原電位;然而透過能斯 特方程式(Nernst equation)代入電池的全反應式,我們可以計算電解質濃度對於電池電動勢的影響。方程式如下:
![]() 其中Q為反應商數(reaction quotient),n為半反應當中的電子傳遞數量。例如前述鋅銅電池的反應商數可寫如下:
其中Q為反應商數(reaction quotient),n為半反應當中的電子傳遞數量。例如前述鋅銅電池的反應商數可寫如下:
![]() 而n = 2。也因此,當電池放電時,鋅離子濃度上升,而銅離子濃度下降,便可以發現Q上升,此時則會造成電池電動勢
而n = 2。也因此,當電池放電時,鋅離子濃度上升,而銅離子濃度下降,便可以發現Q上升,此時則會造成電池電動勢 ![]() 的下降。最終當反應平衡,電動勢下降到一定程度,則無法再進行反應。
的下降。最終當反應平衡,電動勢下降到一定程度,則無法再進行反應。
常見的乾電池、鹼性電池、鉛蓄電池均屬賈法尼電池(碳棒只是導電用)。基本上兩片金屬只要中間夾著的物質能夠提供電解質,而金屬間又有通路可導電或直接接 觸,那麼就會形成一個賈法尼電池。由於陽極的金屬會隨著反應減少(反應為離子),稱為電流腐蝕(Galvanic corrosion)。然而這樣也不是全然是壞處,常見的陰極保護,即是利用電流腐蝕讓較易氧化的金屬當作陽極藉以保護陰極的金屬。
資料來源
1. WIKIPEDIA—Galvanic cell http://en.wikipedia.org/wiki/Galvanic_cell
2. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; pp. 462-471.
3. Atkins, P. W.; Jones, L. Chemical Principles: the Quest for Insight, 4st edition; W. H. Freeman and Company: New York, 2008, p. 506-508.Boston, 2003; pp. 481-486.
4. 圖二圖片來源:http://en.wikipedia.org/wiki/Fil ... _no_cation_flow.png
