【關於 COVID-19 的這大半年】SARS-CoV-2 的拗「毒」絕活
所謂萬事皆有頭。對於包括 SARS-CoV-2 在內的病毒來說,所謂的起頭,大概就是如何堂而皇之、大搖大擺地登「cell」入室;繼而又大搖大擺地,把宿主細胞當自己家,毫不客氣地反客為主,複製起一個又一個的自己。你說,這 SARS-CoV-2 的厚臉皮絕活,是怎麼練起來的呢?我們又有什麼辦法,可以戳破它的千層假面呢?
撰文/駱宛琳
SARS-CoV-2 新型冠狀病毒,如何導致 COVID-19 病情的?
而身為病毒一族,SARS-CoV-2 必須要先進入宿主細胞,才能夠完成其複製大業。而病毒感染宿主細胞的策略,往往也決定了病毒的趨向(tropism)。「疫」至如今,我們已經知道,SARS-CoV-2 所導致的 COVID-19,病徵以呼吸道感染與肺炎為主。換言之,SARS-CoV-2 所欺負的對象,不難猜測是呼吸系統裡的細胞。
那,這些受害者是誰呢?SARS-CoV-2 又是如何看上這些受害者細胞,而專挑其下手的呢?
一如小偷闖空門得先破門,病毒要感染細胞,也得先找到破口。小偷找門窗,病毒則找細胞表面的蛋白質當作臨空而降的著腳處,結合上細胞表面的特定蛋白質之後,便能夠和宿主細胞膜融合,迫使病毒基因組能夠進入宿主細胞,感染細胞。
目前,對於 SARS-CoV-2 的感染策略,我們也已經有了大致的了解。一言以蔽之,SARS-CoV-2 所挑上的下手對象,是宿主細胞表面的第二型血管收縮素轉換酶(ACE2)蛋白質。而綜觀人類呼吸系統邊上排排站哨的細胞群,不少細胞表面都表現了ACE2 蛋白質。像是纖毛狀鼻腔黏膜上皮細胞,就表現了滿滿的 ACE2 蛋白質。除此之外,雖然表現量不及鼻腔黏膜上皮細胞,但纖毛狀枝氣管上皮細胞、還有第二型肺泡細胞上,也都能夠找到 ACE2 蛋白質的蹤跡。主挑 ACE2 蛋白質下手的 SARS-CoV-2,似乎也就不難推斷,其屬性算是呼吸道病毒。
小偷有撬鎖之絕,而 SARS-CoV-2 撬開 ACE2 的絕活,就在病毒表面的棘狀蛋白(spike protein)上。
在專欄的前幾篇裡頭,我們聊過所有的冠狀病毒,都有著棘狀蛋白。冠狀病毒靠著棘狀蛋白作為破細胞而入的利器,而那利器的祕密,正落在棘狀蛋白裡的受器結合域(receptor-binding domain)裡頭。每種冠狀病毒都帶有特殊的受器結合域蛋白質序列,相異的受器結合域也讓各種冠狀病毒,都有各自的看家本領。
SARS-CoV-2 不是唯一盯上第二型血管收縮素轉換酶 ACE2 蛋白的冠狀病毒。像是造成當年 SARS 疫情的 SARS-CoV 病毒,還有常見的感冒病毒 HCoV-NL63,也都利用 ACE2 來感染細胞。至於其他冠狀病毒,另一個狠角色 MERS-CoV,是利用二肽基肽酶 DPP4 來感染人類細胞,而另一種感冒病毒 HCoV-229E,則是利用胺肽酶 CD13 作為侵入細胞的主要攻擊點。換言之,利用上第二型血管收縮素轉換酶 ACE2,不是SARS-CoV-2 之如此難纏的萬惡之源;冠狀病毒裡頭的有些成員之所以讓人束手無策,也不是只有 ACE2 是病毒棘狀蛋白的受氣包。
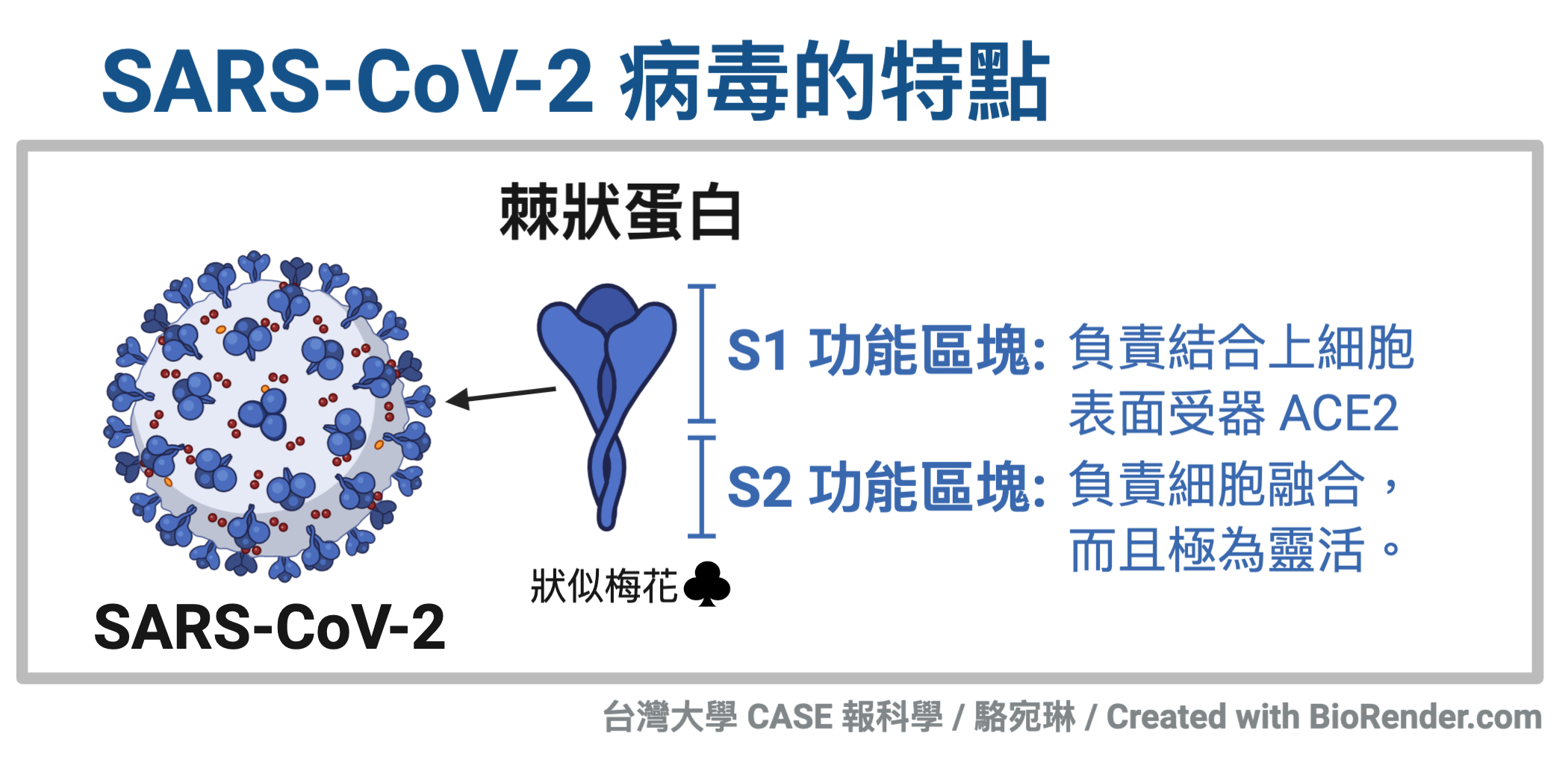
棘狀蛋白長得像撲克牌花色裡的梅花:中間一柱,三面圓凸。中間那一柱,是所謂的 S2 功能區塊,像是棘狀蛋白的腳,在 SARS-CoV-2 病毒感染宿主細胞的時候,負責讓病毒與宿主的細胞膜融合。除此之外,棘狀蛋白還頭戴梅花三瓣,則是所謂的 S1 功能區塊,可以看做是 SARS-CoV-2病毒的三組受器結合域,負責結合上 ACE2。不過,棘狀蛋白可沒有像撲克牌花色那樣樸實無華,梅花三瓣上,可還戴了遮陽帽,好好地利用棘狀蛋白胺基末端的部分,把受器結合域這個重要部位給遮蓋起來。
研究發現,一顆 SARS-CoV-2 病毒表面,平均來說大致帶上了四十組的棘狀蛋白梅花三瓣結構體。這些梅花狀的棘狀蛋白,大多都處於「融合前」的結構狀態。這是什麼意思呢?原來,SARS-CoV-2 感染進入細胞,不單單是棘狀蛋白跟 ACE2 蛋白手勾手,就完成的,而是由層層步驟交相牽引,步步為營下才能夠達陣。
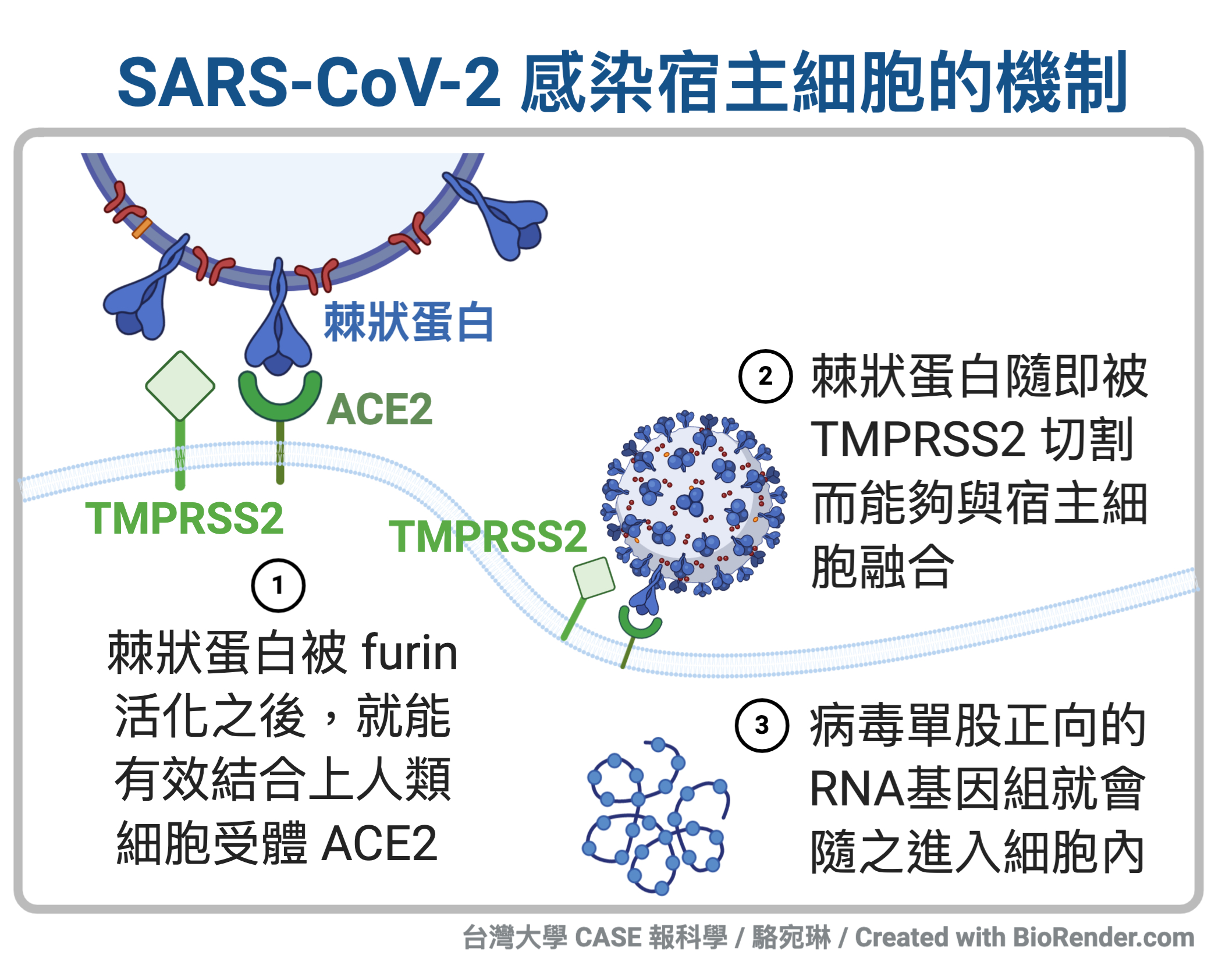
每一組梅花三瓣狀的棘狀蛋白,在 S1與 S2 功能區塊中間,都有兩個重要的蛋白酶切割處。第一個重要的切割處,是留給前蛋白轉化酶 furin 的。前蛋白轉化酶furin 負責將蛋白質「轉大人」:能夠把剛生成好、還不具有完整活性的蛋白轉化修飾為具有活性的成熟蛋白質。 而 furin 在這裡,就是負責活化 S1 與 S2 功能區塊,讓棘狀蛋白進入「準備結合宿主細胞」的備戰狀態。
第二個需要蛋白酶切割功能的重要時刻,是病毒要與宿主細胞膜融合的時候。前蛋白轉化酶furin 活化了棘狀蛋白,棘狀蛋白能夠利用 S1 功能區塊處的受器結合域,和宿主細胞 ACE2 結合。然後,另一個宿主細胞的蛋白酶 TMPRSS2(transmembrane protease serine 2),在棘狀蛋白結合上 ACE2 蛋白之後,就會再次切割,讓棘狀蛋白可以利用 S2 功能區塊來與宿主細胞膜融合,成功達陣。
你說 SARS-CoV-2 為什麼要如此麻煩,設下重重關卡給自己,沒事找事做呢?其實,這些重重關卡,才正是 SARS-CoV-2 的心機所在呢。科學家也懷疑,這些心機,也是造成 SARS-CoV-2 的感染成功率,要大勝 SARS-CoV 的「危」妙所在。
所以,SARS-CoV-2 是如何讓自己,要比近親 SARS-CoV,更容易感染宿主細胞呢?
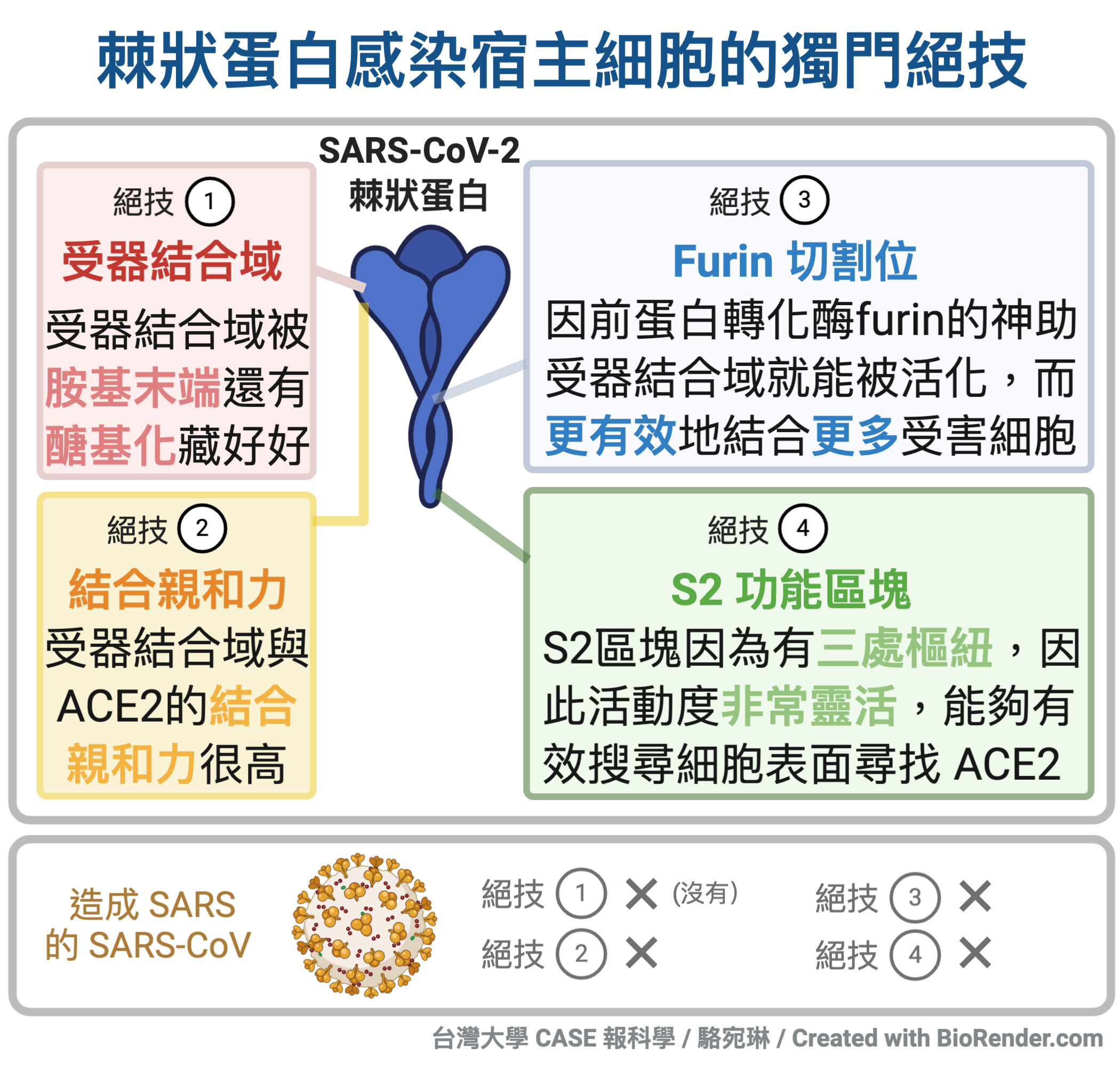
首先,SARS-CoV-2 受器結合域結合上 ACE2 蛋白的親和力強度,要比 SARS-CoV 強上許多,大大增加了 SARS-CoV-2 進入細胞的感染成功率。但同時,SARS-CoV-2 受器結合域,又深諳真人不露相之理,在棘狀蛋白的胺基末端與大量醣基化修飾底下,把自己好好藏著,以便躲過免疫系統(諸如抗體)的攻擊。
至於,那專門留給宿主細胞的前蛋白轉化酶 furin 的切割處,就更有趣了。這個切割位,雖然在 SARS-CoV 上沒有,但也卻不是 SARS-CoV-2 所獨有。在某些也具有高度致病性的病毒身上,也被發現有 furin 前蛋白轉化酶切割的位置。最好的例子,可能是同樣也具有高度致病性的禽流感病毒了。
大部分的病毒在感染宿主細胞之前,病毒外膜上的醣蛋白會需要經過蛋白酶切割後,才能夠進入細胞。於是,要和哪些蛋白酶裡應外合,就很重要了。以禽流感病毒為例,當低致病性的禽流感病毒表面血球凝集素(hemagglutinin)得到 furin 切割位之後,其致病性就會大幅提高。這是因為 furin 是個廣泛存在的細胞蛋白酶,因此,當病毒外膜上的醣蛋白帶有 furin 切割位的時候,病毒能夠感染的細胞種類,就會變廣許多。
科學家也在新城雞瘟病毒(newcastle disease virus)上發現過類似的例子。當新城雞瘟病毒不具有 furin 切割位的時候,只能局部感染某些特定細胞,不過,一但病毒擁有了 furin 切割位,就能夠商借那處處存在的 furin 之助,能夠造成系統性地全「雞」感染。
因此,科學家猜想,雖然單有 furin 沒有辦法一舉讓 SARS-CoV-2 完成感染大事,但有了 furin 此一各個細胞都具有的蛋白酶,或許也能夠讓 SARS-CoV-2 的「受害者」細胞廣度增加,也或許,在 SARS-CoV-2 病毒由蝙蝠傳至人的過程裡,也從中插上一腳,加速了其演化速度。
更重要的是,有了 furin 切割的幫忙,SARS-CoV-2 等於同時在「把受器結合域藏好好」,還有「能夠有效結合宿主細胞表面蛋白質」兩者之間,取得了巧妙的平衡。畢竟,把梅花三瓣藏妥,就能夠免去被免疫系統攻擊的命運。但低頭藏好好的棘狀蛋白,卻又像是拿石頭砸自己的腳,會讓受器結合域,無法有效結合上宿主細胞受體。
的確,科學家發現,雖然 SARS-CoV-2 的受器結合域具有較高的 ACE2 結合親和力,但完整的棘狀蛋白整體,要結合上 ACE2 的能力,卻比 SARS-CoV 要弱許多。不過,有了 furin 這個轉化酶的幫忙之後,棘狀蛋白就可以在接近宿主細胞的時候,才被轉化、修飾為具有高度結合力的「轉大人型」,能夠極度有效地感染宿主細胞。而且, furin 在肺部組織細胞的表現量可是很高的。你說,這是不是心機重重呢?
不過,SARS-CoV-2 的算計,可還不僅止於此呢。最近,德國科學家 Martin Beck 與 Jacomine Locker 博士實驗室合作,一起聯手研究 SARS-CoV-2 棘狀蛋白的結構表現。他們利用冷凍電子顯微術(Cryo-electron microscopy;cryo-EM),好好地把 SARS-CoV-2 的棘狀蛋白,仔細分析了一番。
研究發現,SARS-CoV-2 的棘狀蛋白還有另一項密技:它那撲克牌梅花花色裡的那跟梅花柄,像是長了「髖關節」、「膝關節」還有「踝關節」似地,活動自如。這三個位於 S2 功能區塊的絞合樞紐,讓棘狀蛋白能夠自由不受拘束地這頭轉轉,那裡也轉轉,讓病毒外表為了躲過免疫系統而大量醣基化的過多修飾,並不影響到棘狀蛋白的活動力,棘狀蛋白還是可以活動自如地,好好將宿主細胞表面 ACE2 的蹤跡,搜尋徹底。
有趣的是,ACE2 除了在肺部組織,也在腸道細胞可見。而在臨床上,感染 SARS-CoV-2 的病人,也的確常常出現腸胃道症狀,在約三成的 COVID-19 確診病人的糞便裡,也能夠偵測到病毒 RNA。不過,就像我們在之前所討論過的,能夠在糞便中檢測出 SARS-CoV-2 病毒 RNA,卻不代表 SARS-CoV-2 可以經由糞口途徑傳播。雖然,糞口途徑在蝙蝠身上極為常見,目前科學家卻不認為這會是 SARS-CoV-2 的主要傳播途徑。這可能是因為在腸道裡,病毒很容易腸道裡的特殊環境型態而失去活性。
而 SARS-CoV-2 利用 ACE2 與 TMPRSS2 來感染人類細胞的手段,或許也能夠解釋為什麼在許多 COVID-19 病人身上,嗅覺喪失是最先出現的症狀。因為,支持嗅覺神經元(olfactory sensory neurons)完整性的支柱細胞(sustentacular cell)上,就大量表現了這兩種蛋白質呢。
總而言之,了解了 SARS-CoV-2 感染度如此猖狂的重重心機,也讓科學家能夠更有效地設計出對抗病毒的新藥靶點。在大家同心協力下,希望疫情不但能夠在社會基層上,被好好地控制住,在醫療前線上,也能夠有兵來將擋的好策略!不過,在能夠對症下藥的曙光乍現前,還是有賴我們每一份子,大家都好好地做好防疫本分,好好的守護好台灣喔。
原始研究:
研究 SARS-CoV-2 感染細胞機制的研究論文:
Shang J, Wan Y, Luo C, Ye G, Geng Q, Auerbach A, Li F. Cell entry mechanisms of SARS-CoV-2. Proc Natl Acad Sci U S A. 2020 May 26;117(21):11727-11734. doi: 10.1073/pnas.2003138117. Epub 2020 May 6. PMID: 32376634
研究 SARS-CoV-2 棘狀蛋白活動力極佳的研究論文:
Turoňová B, Sikora M, Schürmann C, Hagen WJH, Welsch S, Blanc FEC, von Bülow S, Gecht M, Bagola K, Hörner C, van Zandbergen G, Landry J, de Azevedo NTD, Mosalaganti S, Schwarz A, Covino R, Mühlebach MD, Hummer G, Krijnse Locker J, Beck M. In situ structural analysis of SARS-CoV-2 spike reveals flexibility mediated by three hinges. Science. 2020 Aug 18;eabd5223. doi: 10.1126/science.abd5223. Online ahead of print.
參考資料:
- Kristian GA. The proximal origin of SARS-CoV-2. Nat Med. 2020 Apr;26(4):450-452. doi: 10.1038/s41591-020-0820-9.
- M Hoffmann, H Kleine-Weber, S Pöhlmann. A multibasic cleavage site in the spike protein of SARS-CoV-2 is essential for infection of human lung cells. Molecular Cell, 2020
- Tay MZ, Poh CM, Rénia L, MacAry PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 2020 Jun;20(6):363-374. doi: 10.1038/s41577-020-0311-8. Epub 2020 Apr 28.
- Matheson NJ, Lehner PJ. How does SARS-CoV-2 cause COVID-19? Science. 2020 Jul 31;369(6503):510-511. doi: 10.1126/science.abc6156.
