【化學反應】鹼金屬(alkali metals)是如何「著火」的?

撰文|葉綠舒
大家對鹼金屬(alkali metals),包含了鋰(元素符號Li)、鈉(Na)、鉀(K)、銣(Rb)、銫(Cs)、鍅(Fr),遇水會「著火」應該都不陌生,有些甚至會爆炸。您甚至可能還看過這個影片:鈉與鉀只是產生猛烈的燃燒反應,但是銣與銫會產生大爆炸!
但是,究竟鹼金屬是如何「著火」或爆炸呢?過去的說法是,因為鹼金屬遇水會造成水的解離,以鈉為例,產生氫氧化鈉(sodium hydroxide,NaOH)與氫氣;而這個反應同時也會產生大量的熱,是這個熱點燃了氫氣,於是就著火了。
這個說法挺合理的,大家也都接受;但是就有人不認為想當然爾的事情就一定是這樣。由捷克與德國所組成的國際科學團隊,決定要來看看到底鹼金屬遇到水的反應是怎麼一回事。
為什麼他們會不接受原先的說法呢?研究團隊說,爆炸需要反應物快速的混合,但如果真如大家過去認為的反應方式,光是因為反應產生的熱所導致的水蒸氣,以及反應本身所產生的氫氣,便足以阻絕更多的鹼金屬接觸到水;這樣是要如何發生接續下去的燃燒,甚至爆炸呢?
研究團隊為了要釐清這個疑點,使用了鈉與鉀的混合物。使用鈉鉀混合物有兩個原因:一是因為鈉常容易在表面發生氧化(如圖),造成無法燃燒;二是因為鈉鉀混合物在常溫是液體,可以一滴滴的將金屬滴入水,容易操作與觀察。
結果,研究團隊看到,在加入金屬後0.4毫秒(millisecond)時,金屬滴四下飛散;但當時還沒有產生大量的熱。接著,每個飛散的金屬滴被深藍/紫色的溶液包圍。
這深藍/紫色的溶液是什麼呢?研究團隊說,這是溶解在水裡的電子。當研究團隊把金屬滴縮小到只剩下十九個鹼金屬原子時,整個現象變得更明朗:表面的鹼金屬原子先丟掉一個電子,電子被周圍的水溶解,然後這些帶正電的鹼金屬離子因為同性相斥而四下飛散--這個現象就是所謂的庫侖爆炸現象(Coulomb explosion)。
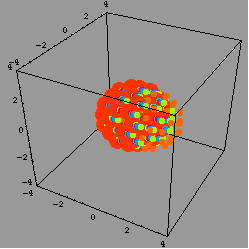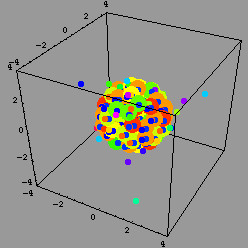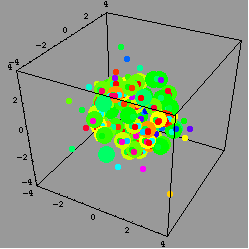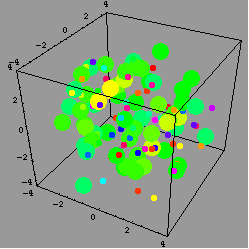
庫侖爆炸是什麼呢?簡單來說,就是兩個電荷之間的作用力與兩個電荷的乘積成正比,當兩個電荷是同性(一樣是負電,或者如本文提到的狀況,一樣是正電)時,這個作用力是斥力;而當兩個電荷是異性(一正一負)時,則作用力為吸引力。
而以本文所提到的為例,當系統中所有的粒子都帶正電時,系統的能量會因為彼此之間的斥力而升高;當電荷量超過臨界值時,系統便會爆炸、分解,就是我們看到的燃燒、爆炸現象。
所以,我們過去多少年以為的「因為鈉與水反應,產生氫氧化鈉與氫氣,然後氫氣被反應所產生的熱點燃」,其實並不是喔!因為當金屬滴開始四下飛散時,那時並沒有大量的熱產生,而是因為彼此的斥力已經使得整個系統到達臨界值了,於是產生庫侖爆炸!
參考文獻:
Philip E. Mason, Frank Uhlig, Václav Vaněk, Tillmann Buttersack, Sigurd Bauerecker; Pavel Jungwirth. 2015. Coulomb explosion during the early stages of the reaction of alkali metals with water. Nature Chemistry. doi:10.1038/nchem.2161.
Phillip Ball. 2015/1/26. Sodium's explosive secrets revealed. Nature News.
--
作者:葉綠舒 慈濟大學生命科學系助理教授,科教中心特約寫手,從事科普文章寫作。

「因為鈉與水反應,產生氫氧化鈉與氫氣,然後氫氣被反應所產生的熱點燃」其實也是吧?
庫倫爆炸只解釋了斥力,亦即爆炸力,但像鉀跟鈉反應比較微弱,庫倫爆炸無法解釋其火焰(火焰需要燃燒熱及燃燒物,也就是反應熱及氫氣)
應該是這樣
鈉與鉀的庫倫爆炸較小,一般燃燒是因為鈉與水反應,產生氫氧化鈉與氫氣,然後氫氣被反應所產生的熱點燃,所以外顯的反應是"燃燒"。
銣銫則是因庫倫爆炸較激烈,所以外顯的反應是"爆炸"(因為連氫氣都被炸散了自然看不到燃燒)。
維基條目有說明,庫倫爆炸本身是"冷"的過程,在熱傳導到足夠遠的地方前,庫倫爆炸已經先完成了
燃燒的過程應該是帶正電的鹼金屬離子被強大的斥力高速推開,因為與週遭流體的摩擦產生高熱,才會點燃生成的氫氣
過去認為是鹼金族生成放熱才會產生燃燒,是不正確的解釋方式