鹵素含氧酸(Halogen Oxyacids)
鹵素含氧酸(Halogen Oxyacids)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
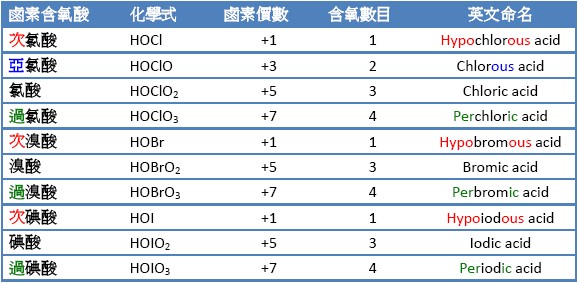
鹵素含氧酸(Halogen Oxyacids),是指除了氟以外的鹵素元素和 氧以不同比例形成的含氧酸,表一為所有目前已知鹵素含氧酸。相對於鹵素含氧酸,不含氧但含鹵素的酸類,則稱作氫鹵素含氧酸(hydrohalic acids),例如氫氟酸(HF)、氫氯酸(HCl)、氫溴酸(HBr)和氫碘酸(HI)。鹵素含氧酸與氫鹵素含氧酸都是單質子酸,在水中會解離出氫離 子。
氫鹵酸當中的鹵素,其氧化數是-1,溶於水中為酸,氣態化合物則稱作鹵化氫。反之,鹵素含氧酸當中的鹵素,根據與其化合之氧的數目增加,氧化數由+1、+3、+5到最高+7價。鹵素含氧酸依照所含的氧的數目,由1到4我們可以依序稱為次鹵酸(hypohalous acid,HXO)、亞鹵酸(halous acid,HOXO)、鹵酸(halic acid,HOXO2)、過鹵酸(hyperhalic acid,HOXO3)。而其中的氧,氧化數都是-2。因為鹵素含氧酸的鹵素的氧化數為正,可以透過鹵素的還原,來氧化許多的物質,故鹵素含氧酸都具有強氧化性。