離去基 (leaving group)
離去基 (leaving group)
國立臺灣師範大學化學系碩士班二年級胡婷嘉研究生
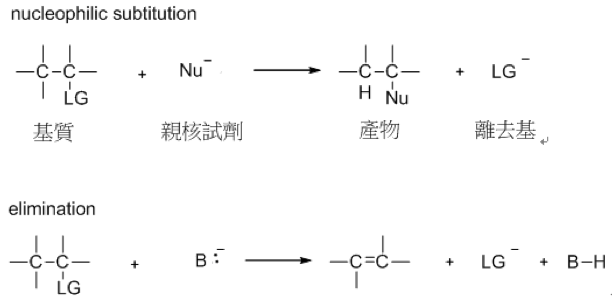
在親核取代反應(nucleophilic substitution)和消去反應(elimination)中,離去基的好壞占有決定性的因素。在親核反應中,從被親核試劑攻擊的分子上,帶著一對電子斷裂出去的原子或基團稱為離去基(leaving Group),一般用 L 或 LG 代表,可以為帶電的離子,也可以為不帶電的中性分子。
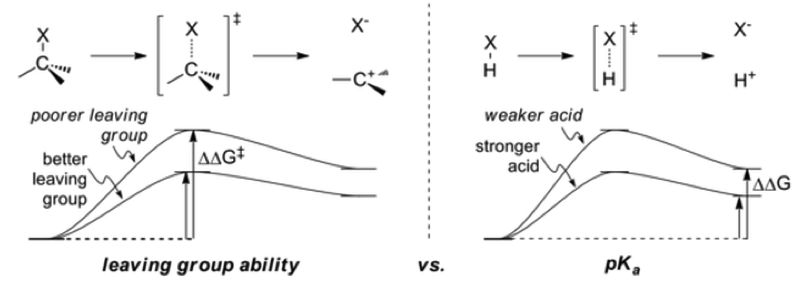
在 $$S_N2$$ 反應中,離去基有兩個作用,第一個是極化碳和離去基之間的鍵,使碳微帶正電讓親核試劑更容易攻擊。第二個是可以帶一對電子離去。
所以要符合這兩個條件,好的離去基電負度要很大,像是鹵素、氧、氮…等,來極化碳和離去基之間的鍵,電負度越大拉電子的能力越大就可以使碳帶正電,使反應進行的更順利。而顧名思義,離去基要很容易離去的才是好離去基,離去之後較為穩定。
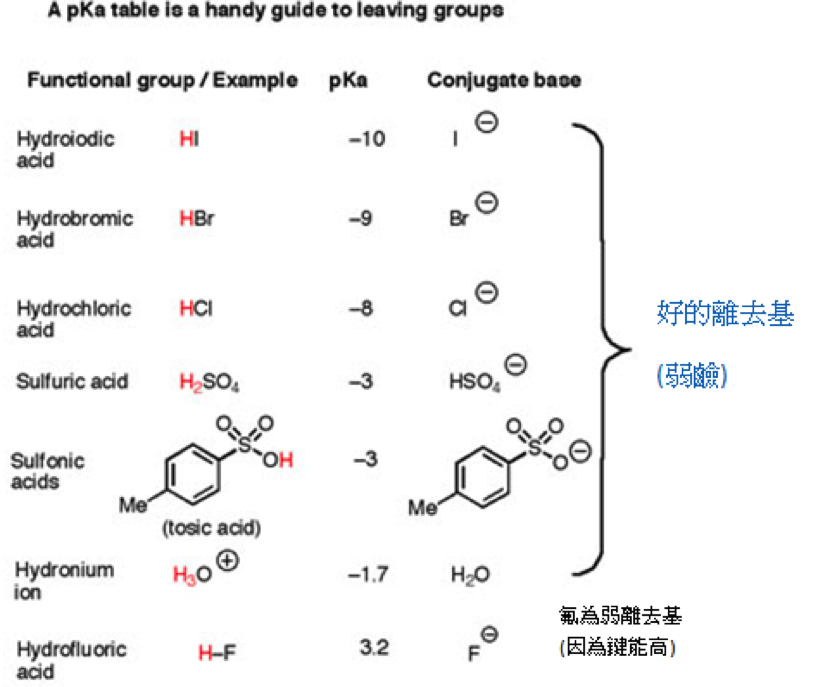
當酸的酸性越強時,氫離子越容易解離,所以解離後的共軛鹼越能穩定的存在,不須和其他的基團結合,能夠以中性或鹼性離去基團形式存在的機會就越高,故強酸的共軛鹼(弱鹼)才能當好的離去基,因為共軛酸的 $$pKa$$ 越小,像是 $$\mathrm{HCl}$$、$$\mathrm{HBr}$$、$$\mathrm{HI}$$ 分別為 $$-8$$、$$-9$$、$$-10$$ 屬於強酸,所以他們的共軛鹼 $$\mathrm{Cl^-}$$、$$\mathrm{Br^-}$$、$$\mathrm{I^-}$$ 為很弱的鹼也是好的離去基。
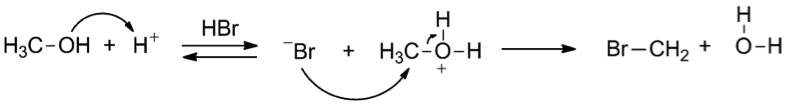
以式一為例,$$\mathrm{Br^-}$$ 不會回去攻擊碳,且穩定的存在。$$\mathrm{Br}$$ 就是好的離去基。
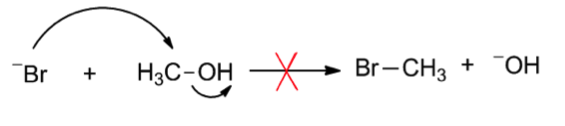
式二中的反應不會進行,因為 $$\mathrm{^-OH}$$ 是強鹼是好的親核試劑不是好的離去基,會再回去攻打碳,進行式一的反應。如果想讓反應進行的話就要把 $$\mathrm{OH}$$ 質子化成 $$\mathrm{H_2O}$$ 成為好的離去基以後才能進行。
以式三為例,水就是好的離去基,因為水是弱鹼,不會再攻擊碳且可以穩定的存在。所以當在進行 $$E1$$ 或 $$S_N1$$ 反應時,如果沒有好的離去基,通常會用質子化的過程讓不好的離去基變成好的離去基才能利於反應的進行,像上面的式三。
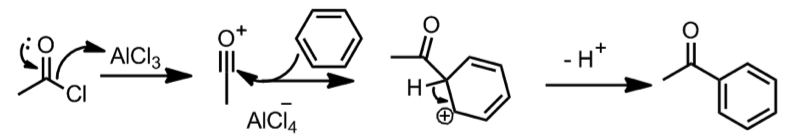
在很多反應中我們也可以看到將離去基活化來進行反應的例子,像是在 Friedel-Crafts 反應中,需要一個路易士酸來使離去基脫去而形成碳陽離子才能使反應進行,如下式四:
$$\mathrm{AlCl_3}$$ 為路易士酸,在反應中活化離去基(氯離子),氯離子離去之後在進行接下來一連串的反應。
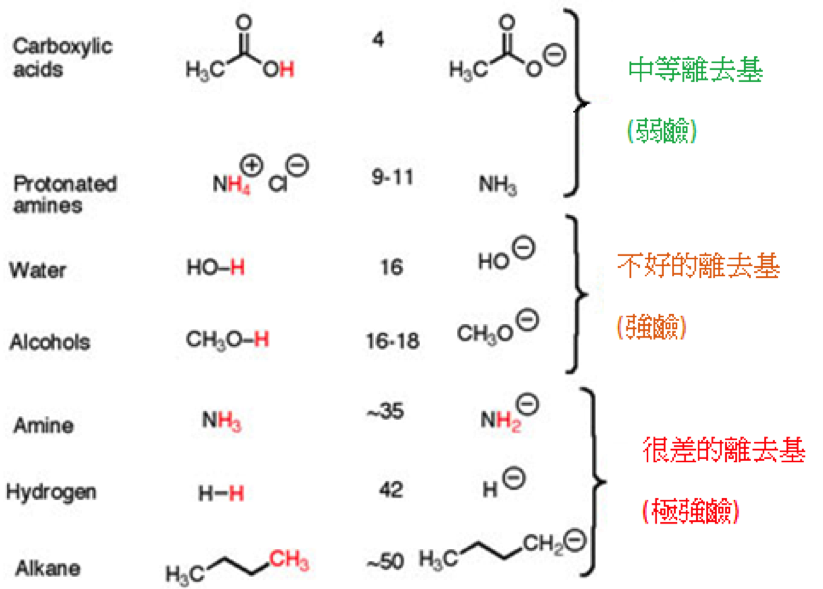
表一
最後,由上面的表格一,我們可以很明顯的看出來他們當離去基的趨勢。前面的都是好的離去基,因為他們的共軛酸酸性很強,比較容易離去,後面的就是鹼性較強的基團,所以他們不是好的離去基。最後來看看在中間的氟離子,雖然氫氟酸也算是滿強的酸,且氟的電負度也很大,但碳氟鍵太強,所以很不容易解離,因此氟離子不是好的離去基。
參考資料
- Wade, L.G. Jr (2010), organic chemistry, P237-240, P246.
- Carey, F. A. (1992), organic chemistry, P307-308, P329, P324.
- 圖一http://en.wikipedia.org/wiki/Leaving_group
- http://en.wikipedia.org/wiki/Friedel%E2%80%93Crafts_reaction
- 表格一http://www.masterorganicchemistry.com/2011/04/12/what-makes-a-good-leaving-group/


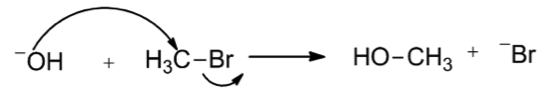
 前一篇文章
前一篇文章 下一篇文章
下一篇文章
