苯炔
苯炔 (benzynes)
國立臺灣師範大學化學系碩士生 薛園馨
苯炔 (benzynes) 是苯環上一個雙鍵藉由脫去反應 (elimination reaction),得到帶有兩個雙鍵一個三鍵的六員環高活性分子,因六員環構型關係,本來鍵角應該是 180 度的三鍵 SP 混成軌域被扭曲而遠小於180度,這強大的角張力 (angle strain) 讓苯炔的三鍵性質變弱,在化學家的眼中苯炔更像是兩性離子 (zwitterion) 或雙自由基 (biradical) 的分子,而紅外光譜學 (infrared spectroscopy) 也佐證了這個現象,Rasziszhewski 教授在 1992 年發表在國際期刊1 上測出來苯炔的紅外光譜是在 1846 cm-1,鍵能比三鍵 (~2250 cm-1) 弱很多,而其如 NMR、UV 等光譜學都有類似結果,而這項性質被化學家廣泛應用在各種合成策略上,如親核加成、[4+2] 或 [2+2] 的環加成 (cycloaddition) 反應或插入反應 (insertion reactions) 等等。
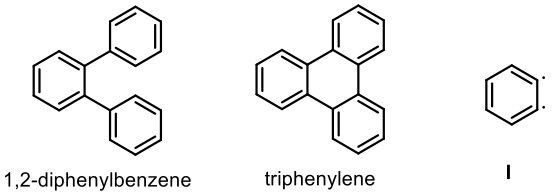
苯炔的發現一開始是 Bachmann 教授的假設,因為他們實驗室想要大量生產苯基苯 (biphenyl),於是他們在沸騰的氯苯加入金屬鈉進行伍茲反應 (Wurtz coupling)2,他雖然得到了苯基苯,但更多的是意料之外的產物 1,2-雙苯基苯 (1,2-diphenylbenzene)、聯伸三苯 (triphenylene),這只能用自由基來解釋,於是 Bachmann 教授遍假設了一個中間體,苯環上帶有雙自由基的中間體 I。
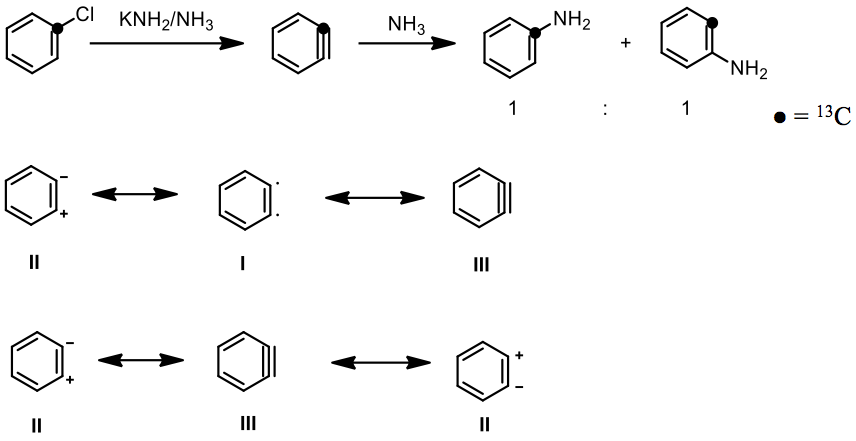
接下來是諾貝爾獎得主格奧爾格.維蒂希 (Georg Wittig) 和他的學生在 1 號位有鹵素取代的苯環加入苯基鋰的反應中發現氟苯速率最快,這與親電取代反應速率相反(碘>溴>氯>氟),因此他們假設了一個雙極 (dipolar) 中間體 II 來解釋這個結果3,最後提出苯炔結構強而有力的證據是麻省理工 John D. Roberts 教授,他的團隊利用 13C 同位素標定氯苯上的 1 號碳,藉由加強鹼以及液氨的條件下得到兩個 1:1 的產物,證明了苯炔的共振式 III(圖二)。
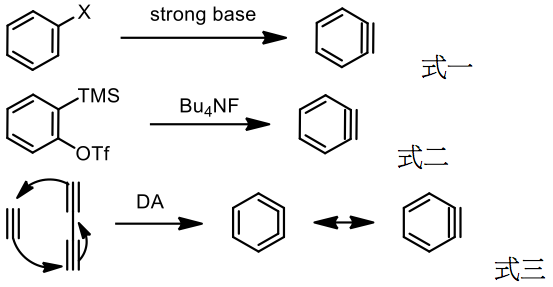
由於苯炔的高活性與無法純化的特性,在使用苯炔合成策略的時候往往要一鍋化,現今合成苯炔的方法是利用脫去反應,依官能基的不同又有分:
[1] 鹵苯加強鹼脫去一分子的鹵化氫(式一),其缺點是要加入強鹼可能破壞其他官能基或產生副反應。
[2] 含三甲基矽基與三氟甲磺酸基的苯環加入氟試劑,利用氟負離子與矽形成矽氟鍵,碳上孤對電子回推脫去三氟甲磺酸形成苯炔,此條件是較溫和合成苯炔的條件。4
[3] 利用六氫狄耳士-阿德爾反應 (hexadehydro Diels-Alder reaction, HDDA) 合成苯炔,優點是起始物製備簡單。5
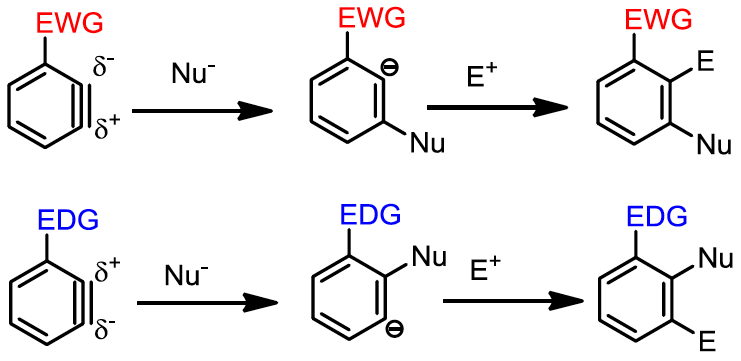
苯炔的應用有很多,利用其共振式中有兩性離子的形式,他可以被親核試劑攻擊,也可以攻擊親電試劑,再加上利用官能基電子效應與共振效應更可以控制其立體化學(圖三),其中親核試劑可以是鋰試劑、銅試劑、格里納試劑等等,想在苯環上接上支鏈,苯炔是一個很不錯的合成策略。
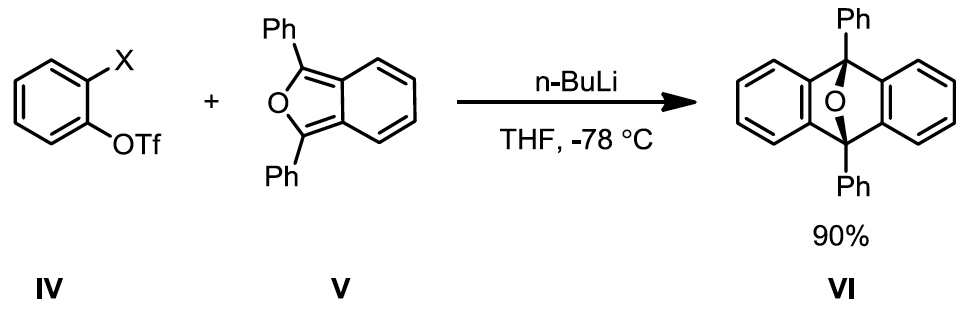
苯炔另外一個很著名的應用是可以在狄耳士-阿德爾反應中當親二烯物 (dienophile),在利用帶有鹵素與可以當好離去基的三氟甲磺酸基的苯環加入 1,3-雙苯基異苯并呋喃 (1,3-diphenylisobenzofuran) V,加入正丁基鋰可以一鍋化的得到帶有環氧化官能基的蒽VI(圖四)。6
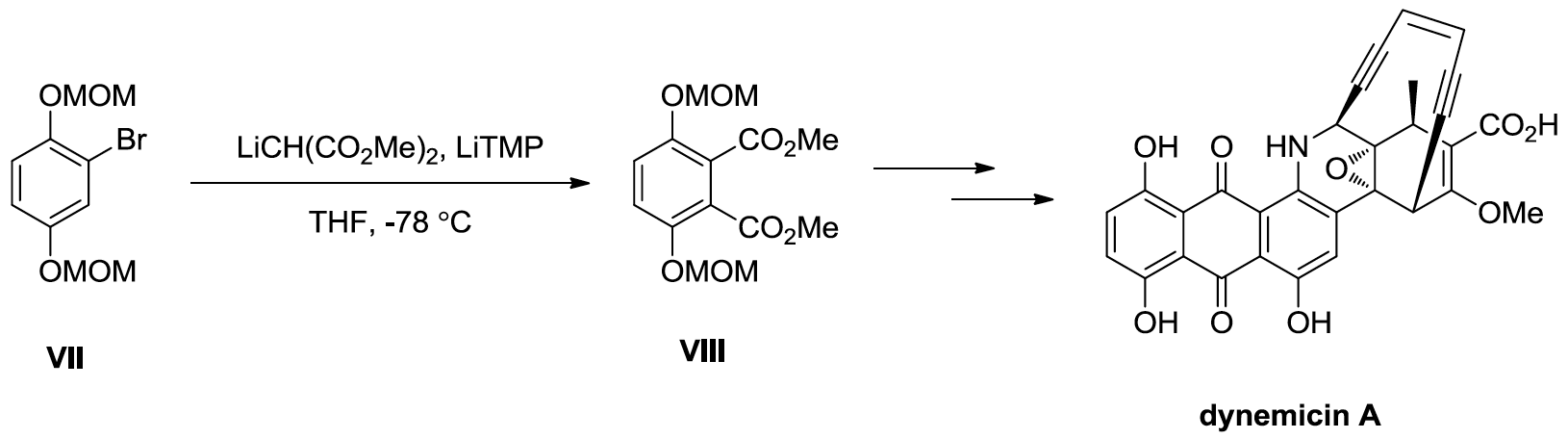
苯炔化學已經是一個被廣泛討論的化學,其應用並不只有以上所提的兩個例子,在許多藥物、全合成上也是一種合成利器,如 dynemicin A 是一種從印度土壤中分離出來的天然物,也是一種抗癌藥物,其全合成便要利用到苯炔的化學,如圖五所示:溴化物 (VII) 與有機鋰試劑 (LTMP) 反應後,會先形成具有苯炔結構的中間體,再經過加成反應後得到中間產物 (VIII),之後再經多步合成可以得到目標產物 dynemicin A。由此例可以證明利用苯炔快速地建立多環產物是非常棒的選擇。7
參考文獻
- Radziszewski, J. G., Hess Jr, B. A., & Zahradnik, R. (1992). Infrared spectrum of o-benzyne: experiment and theory. Journal of the American Chemical Society, 114(1), 52-57.
- Bachmann, W. E., & Clarke, H. T. (1927). THE MECHANISM OF THE WURTZ-FITTIG REACTION1. Journal of the American Chemical Society, 49(8), 2089-2098.
- Wittig, G. (1942). Phenyl-lithium, der Schlüssel zu einer neuen Chemie metallorganischer Verbindungen. Naturwissenschaften, 30(46), 696-703.
- Tadross, P. M., & Stoltz, B. M. (2012). A comprehensive history of arynes in natural product total synthesis. Chemical reviews, 112(6), 3550-3577.
- Hoye, T. R., Baire, B., Niu, D., Willoughby, P. H., & Woods, B. P. (2012). The hexadehydro-Diels–Alder reaction. Nature, 490(7419), 208-212.
- Matsumoto, T., Hosoya, T., Katsuki, M., & Suzuki, K. (1991). New efficient protocol for aryne generation. Selective synthesis of differentially protected 1, 4, 5-naphthalenetriols. Tetrahedron letters, 32(46), 6735-6736.
- Shair, M. D., Yoon, T. Y., Mosny, K. K., Chou, T. C., & Danishefsky, S. J. (1996). The total synthesis of dynemicin A leading to development of a fully contained bioreductively activated enediyne prodrug. Journal of the American Chemical Society, 118(40), 9509-9525.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
