蒸氣壓
蒸氣壓 (Vapor Pressure)
國立臺灣大學化學系陳藹然博士/國立臺灣大學化學系黃俊誠博士責任編輯
蒸氣壓,顧名思義就是指蒸氣的壓力。
蒸氣從哪裡來?所有的凝態物質(Condensed material),包含液態和固態物質,其物質表面的粒子只要從環境中吸收了足夠的能量,都會有脫離物質表面變成氣體粒子的機會,這些變成氣態的粒子就是此物質的蒸氣 (Vapor),如果是液體變氣體稱之為蒸發或汽化 (Vaporation),固體變氣體的話則是昇華(Sublimation)。
當物質被放置於一個密閉容器中,蒸氣粒子的運動範圍受到容器的限制開始撞擊器壁,蒸氣粒子撞擊器壁所產生的壓力就稱之為「蒸氣壓」。部分被器壁彈回的氣體粒子碰撞到了凝態物質表面,因為本身具有的能量不足以脫離物質表面,重新被凝態粒子吸引停留在物質中,這個過程稱為「凝結 (Condensation)」。如果凝態物質為液體時,我們則稱此蒸氣凝結為液體的過程為「液化(Liquification)」。
蒸氣壓隨溫度變化,定溫下,當蒸發(汽化)速率等於凝結或液化速率時,液體上方的氣體粒子數目不變,達到一個動態平衡 (Dynamic equilibrium),其平衡壓力也不變,稱為該物質在該溫度時的「飽和蒸汽壓」或平衡蒸氣壓(Equilibrium vapor pressure),簡稱為蒸氣壓。可參考下列網站動畫(Flash) http://www.mhhe.com/physsci/chemistry/e … aporv3.swf
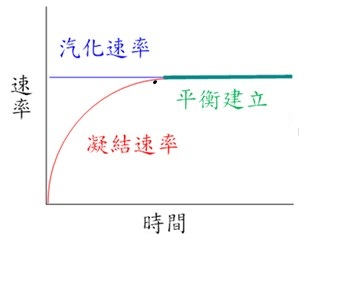
蒸氣壓是物質的基本性質之一,和物質的種類、溫度有關,和物質的表面積無關。同溫下,物質的分子間作用力愈小,分子愈易汽化。例如乙醚和乙醇,乙醚分子比乙醇大,但25度時乙醚的蒸氣壓 (Pvapor (25oC) = 520 torr)卻比乙醇的蒸氣壓(Pvapor (25oC) = 75 torr)大了7倍,這是因為乙醚分子之間是以微弱的偶極-偶極力 (Dipole-dipole force)和倫敦力 (London force)連結,而乙醇分子和分子間除了偶極-偶極力和倫敦力外還有很強的氫鍵(Hydrogen bond)存在。
一般而言,固體的蒸氣壓遠小於液體的蒸氣壓,這是因為固體粒子之間的相互作用力大於液體粒子之間的相互作用力,能夠從固態物質表面昇華成氣態分子的數目很少,蒸氣壓自然很低。但是也有一些例外,譬如樟腦(naphthalene)或乾冰(dry ice),20度時乾冰的蒸氣壓為5.73 MPa (831 psi, 56.5 atm)。這些在室溫下也有很高蒸氣壓的物質,通稱為具揮發性(Volatile)物質。有關揮發性物質將另章討論。
物質的蒸氣壓除了與物質的種類有關,溫度也會影響蒸氣壓。溫度上升,較多的凝態物質表面粒子有足夠的能量,可以脫離物質表面變成氣態粒子,分子容易汽化或昇華,同時氣態粒子也擁有較高的動能,碰撞器壁的頻率增加,蒸氣壓上升。
參考網站及文獻
1. http://en.wikipedia.org/wiki/Vapor_pressure
2. http://www.chem.purdue.edu/gchelp/liquids/vpress.html
3. http://hyperphysics.phy-astr.gsu.edu/hbase/kinetic/vapcon.html#c1


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
