水的三相點不止一個
水的三相點不止一個
國立臺灣師範大學化學系兼任教師邱智宏
高中化學課程介紹相圖(phase diagram)時,常以大家耳熟能詳的「水」開始,探討其在不同溫度、壓力下的狀態變化。然而水的相圖,卻非常態,而是少數的例外,大多數純物質的相圖和水的長相不同,因此如何理解其不同的原因,便顯得格外重要。另外,水在高壓時的相圖卻甚少提到,其性質與低壓的情況是否相同?有没有 $$100^\circ C$$ 的冰?水的三相點僅有一個嗎?
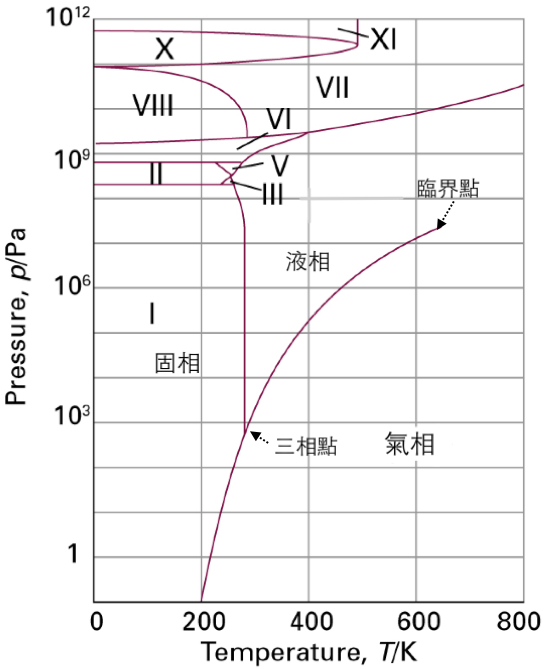
一般高中教科書中有關水的相圖,其壓力僅顯示約在 $$10^8~Pa$$ 以下的範圍
($$1~atm=1.01\times 10^5~Pa$$)以觀察其不同溫度及壓力下,狀態的改變情況。圖一為水在更大壓力範圍下的相圖,恰恰在 $$10^8~Pa$$ 以上,水的相圖有著精彩的發展,在高壓的範圍內,冰的固體存在各種不同的結構,除常見的冰I以外,尚有冰II、冰III、冰V⋯等共八種。
首先,水的相圖和其他純物質最大的不同,即壓力在 $$10^8~Pa$$ 以下時,其固液共存線(熔點線)非常陡峭,而且向左傾斜,亦即斜率為負。其他大部分的物質斜率為正,其原因說明如下:
當同一物質的 $$\alpha,\beta$$ 兩相達到平衡時,其化學能(chemical potential,$$\mu$$)相等:
$$\mu_\alpha(p,T)=\mu_\beta(p,T)~~~~~~~~~(1)$$
由熱力學的基本公式得知 $$d\mu=-S_mdT+V_mdp$$,
其中 $$S_m,V_m$$ 為物質的莫耳熵(molar entropy)和莫耳體積,將此式代入 $$(1)$$ 式
$$-S_{\alpha,m}dT+V_{\alpha,m}dp=-S_{\beta,m}dT+V_{\beta,m}dp$$
$$(V_{\alpha,m}-V_{\beta,m})dT=(S_{\alpha,m}-S_{\beta,m})dp$$
$$\displaystyle\frac{dp}{dT}=\frac{\Delta S_m}{\Delta V_m}~~~~~~~~~(2)$$
式 $$(2)$$ 稱為克拉伯隆方程式(Clapeyron equation),
其中 $$\Delta S_m$$ 為兩相間莫耳熵的差,而 $$\Delta V_m$$ 為兩相間莫耳體積的差。
在固-液兩相中,液相的莫耳熵(或亂度)顯然比固相為大(分子在固相中的排列較整齊,亂度小),$$\Delta S_m$$ 為正值。一般情況下,液相的莫耳體積也比固相大,所以 $$\Delta V_m$$ 亦為正值,因此由式 $$(2)$$ 壓力隨溫度改變的量(即斜率)為正值,在相圖中熔點線,隨壓力的增加,熔點亦隨之上升。
另外,由於液相和固相的體積相差甚微,因此依據式 $$(2)$$ 所畫的線段斜率很大,即其線段很陡峭,而且是向右傾斜。
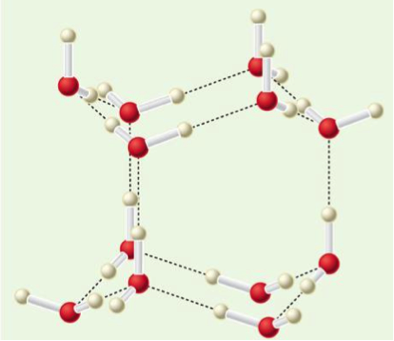
然而在 $$\mathrm{H_2O}$$ 的情形則不一樣,冰I的結構如圖二所示,固相的水分子之間,存在許多氫鍵,形成較不緊實的六方結構,熔解形成液相時,部分氫鍵破壞,造成液相的體積比固相小,因此 $$\Delta V_m$$ 為負值,即式 $$(2)$$ 的斜率為負。
顯然這個小小的異常現象,即加熱使冰熔解,體積反而增大,對自然界非常重要。因為它就是造成冰塊會浮於水上、嚴冬湖海的結冰由表面開始、水底生物不致滅絕的主要原因。
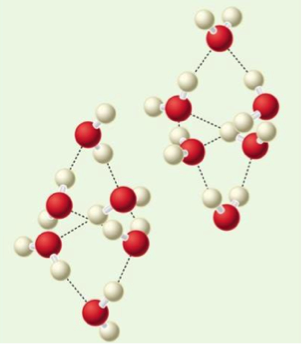
其次由圖一水的相圖可以看出,當壓力在 $$10^8~Pa$$ 以上時,冰會出現多種不同的結構,例如冰VI的結構如圖三所示,當壓力升至 $$10^9~Pa$$ 附近時,其間水分子重新調整結構,部分氫鍵消失,形成比冰I更為緊實的結構,密度增大,其固液相共存線的斜率也由負變正,即壓力加大時,熔點上升,這個情況和低壓的情形完全不同。由圖中可看出在高壓下,將出現在 $$100^\circ C$$(即 $$373.15~K$$)才熔解的冰。
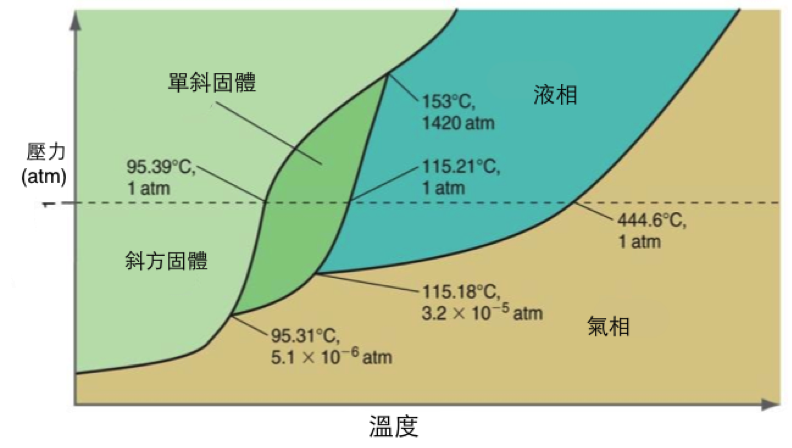
另外,水的三相點,除了(液)(固)(氣)三相共存的點以外,尚有許多(固$$\alpha$$)(固 $$\beta$$)(液)三相共存的點,即水的三相點並不只有一個。顯然許多純物質均存在數個三相點,例如圖四中硫的相圖,就有三個三相共存的點,其中二個出現在 $$1~atm$$ 以下。由相圖中可看出,在 $$1~atm$$ 時,斜方硫在低溫時較穩定,當溫度升高至 $$95.39^\circ C$$ 時,開始轉變成單斜硫,溫度繼續升高至 $$115.21^\circ C$$,固相開始熔化成為液體。通常在相圖中,三相點可能不是只有一個點,但是各純物質的臨界點(critical point ),可是獨特唯一的一個點。
參考資料
- http://www2.chem.uic.edu/tak/chem34013/Chem%20340%20-%20Notes%209.pdf
- P. W. Atkins, “Physical Chemistry”, Oxford University Press, Oxford, 5th ed., p. 186~200 (1994).
- 葉名倉,劉如熹,邱智宏,周芳妃,陳建華,陳偉民,高級中學化學選修上冊,南一書局,第121頁,2013 年。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章

此公式 −Sα,mdT+Vα,mdp=−Sβ,mdT+Vβ,mdp
換算後並不等於 (Vα,m−Vβ,m)dT=(Sα,m−Sβ,m)dp
應該是 (Vα,m−Vβ,m)dp=(Sα,m−Sβ,m)dT
請修改