影響雙分子親核基取代反應速率之因素
影響雙分子親核基取代反應速率之因素
國立臺灣師範大學化學系四年級學生劉曉橋
一. 簡介 $$S_N2$$ reaction:
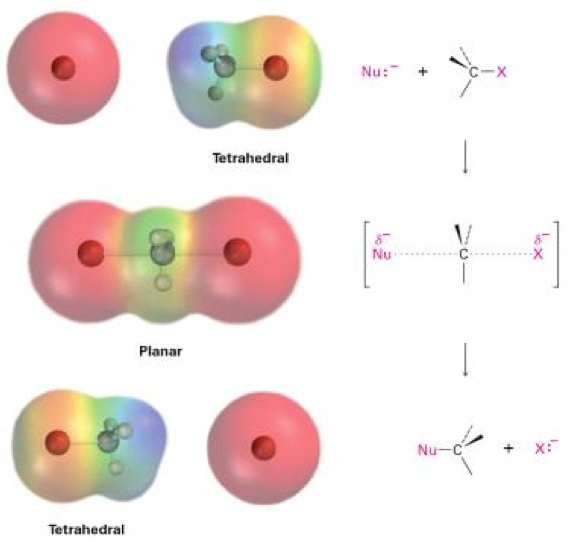
$$S$$ 代表取代(substitution),$$N$$ 代表親核性的(nucleophilic),$$2$$ 則代表兩個分子,即此反應有兩個分子參與速率決定步驟(rate determing step)。此反應為親核基取代反應的其中一種,且僅有單一步驟。而在化學動力學上,$$S_N2$$ 反應為一個二級反應,其反應速率正比於二反應物濃度,即:$$\mathrm{R=k[Nu:^-][RX]}$$
反應發生時,親核基團由離去基(Leaving group,此處為鹵素基 $$\mathrm{X^-}$$)的另一側進入反應,與中心的碳原子形成部分的鍵結,同時離去基與中心碳原子的鍵結也會部分斷裂,此時稱為過渡狀態(transition state)。這個狀態下,與中心碳原子相接的另外三個鍵結會形成一平面結構。最後,離去基與中心碳原子共用的電子完全轉移到離去基身上,並隨著離去基離開,而親核基團與中心碳原子的鍵結完全形成。
二. 影響反應速率的因素
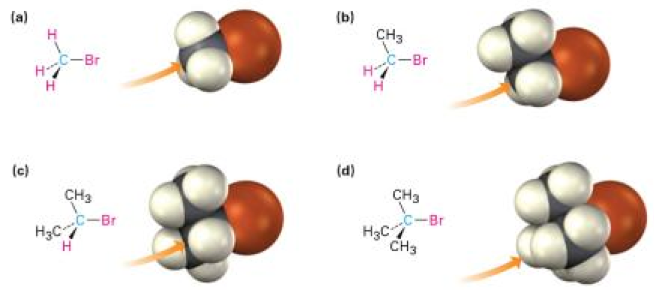
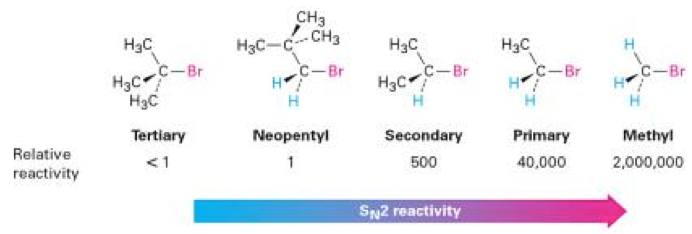
(一) 立體障礙(Steric effect)
如前述反應機制中所提,親核基要進入反應須由取代基的另一側進入。故中心碳原子附近的基團的大小,便對整個反應的反應速率有所影響。舉圖二為例,當中心碳原子附近皆為體基很小的 $$\mathrm{H}$$ 原子時(如a),親核基團要進入反應時所遇到的阻礙則較少,故反應速率快;反之,當中心碳原子附近甲基 $$\mathrm{-CH_3}$$ 越多,親核基團要進入反應時所遇到的阻礙越大(即為立體障礙),故反應速率會逐漸下降。
(二) 親核基強度(親核性,Nucleophilicity)
另一個影響 $$S_N2$$ 反應的重要因素為親核基強度。而凡是有孤對電子的物質(也就是路易士鹼),皆可作為親核基。即使是同一親核基,其親核性會因為受質、溶劑、反應物濃度的不同而有所差異,故要比較不同親核基之間親核性的差異並非簡單的事,但大致上仍會有一定的趨勢:
- 當親核基有相同反應的原子時,通常鹼性(basicity)越強的物質親核性也越強;例如:$$\mathrm{^-OH>{CH_3CO_2}^->H_2O}$$。此例子中,三者皆以 $$\mathrm{O}$$ 原子上的孤對電子進行反應。有此趨勢的原因為:親核性是指路易士鹼對 $$S_N2$$ 反應中碳原子(偏正電)的親性,而鹼性則是對質子的親性,故可見兩者有一定的關聯。
- 週期表上同一行的元素中,通常越下方的元素親核性越強,因為越下方的元素,其價電子住在越外層,因此離核越遠,所受到的束縛越小,故反應性越大;例如:$$\mathrm{I^->Br^->Cl^-}$$、$$\mathrm{HS^->HO^-}$$。(此親核性的順序可能因所處的溶劑不同而有所改變。)
- 帶負電性的親核基通常較中性的親核基親核性強。也因此,進行 $$S_N2$$ 反應時常在酸性環境下而非鹼性或中性的環境。
(三) 離去基(Leaving group)
離去基,也就是 $$S_N2$$ 反應中被取代的官能基,其性質對反應速率亦有影響。凡是越能夠使反應中過渡狀態的負電荷穩定者,通常是越好的離去基,反應速率則越快。因此越弱的鹼通常是越好的離去基,如:$$\mathrm{I^-}$$、$$\mathrm{Br^-}$$、$$\mathrm{Cl^-}$$;反之強鹼通常為不好的離去基,如:$$\mathrm{^-OH}$$、$$\mathrm{^-NH_2}$$。
(四) 溶劑
- 帶有氫鍵的溶劑(protic solvent),如有 $$\mathrm{-OH}$$、$$\mathrm{-NH}$$ 官能基的溶劑分子,會降低 $$S_N2$$ 反應的速率。因為其 $$\mathrm{H}$$ 原子會包覆在親核基的周圍,形成一個籠子,此現像稱為溶劑化(solvation),反應速率下降。
- 不帶有氫鍵的極性溶劑(polar aprotic solvent)則會使 $$S_N2$$ 反應的速率變快;因為其溶劑分子會使親核基能量上升,反應活化能下降,反應速率因而變快。
三. 參考資料
- WIKIPEDIA-SN2 reaction-http://en.wikipedia.org/wiki/SN2_reaction
- John McMurry, Organic Chemistry, 7 ed, 2008, pp362-372.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
