反應焓的聯想(二)
反應焓的聯想(二)(Thoughts on reaction enthalpy (II))
國立臺灣師範大學化學系兼任教授 邱智宏
連結:反應焓的聯想(一)
現以溫度為 298.15 K 時由氫氣及氧氣生成 $$1$$ 莫耳水蒸氣為例,說明如何求出其標準莫耳反應焓,並藉以釐清反應焓、生成焓及相對焓的異同。
$$\displaystyle\mathrm{H_{2(g)}}+\frac{1}{2}\mathrm{O_{2(g)}}\rightarrow \mathrm{H_2O_{(g)}}~~~~~~~~~(5)$$
一般定義一莫耳純物質若由其成分元素經反應化合而成,則其焓的變化量稱為該物質的莫耳生成焓。由此定義可知,在參考狀態下元素的莫耳生成焓為 $$0$$,因為自己變成自己,焓並不會改變。在標準狀態下計算 $$(5)$$ 式化學反應的反應焓 $$(\Delta_rH^{\circ}_{m,T})$$ 即稱為標準莫耳反應焓,在此例中正好也是水蒸氣的莫耳生成焓 $$(\Delta_fH^{\circ}_{m,T}(\mathrm{H_2O_{(g)}}))$$,可透過下式求出,即生成物的莫耳相對焓乘以相對應係數,減去反應物的莫耳相對焓乘以相對應係數:
$$\Delta_rH^{\circ}_{m,T}=1\times H^{\circ}_{m,T}(\mathrm{H_2O_{(g)}})-1\times H^{\circ}_{m,T}(\mathrm{H_{2(g)}})-\frac{1}{2}\times H^{\circ}_{m,T}(\mathrm{O_{2(g)}})~~~~~~~~~(6)$$
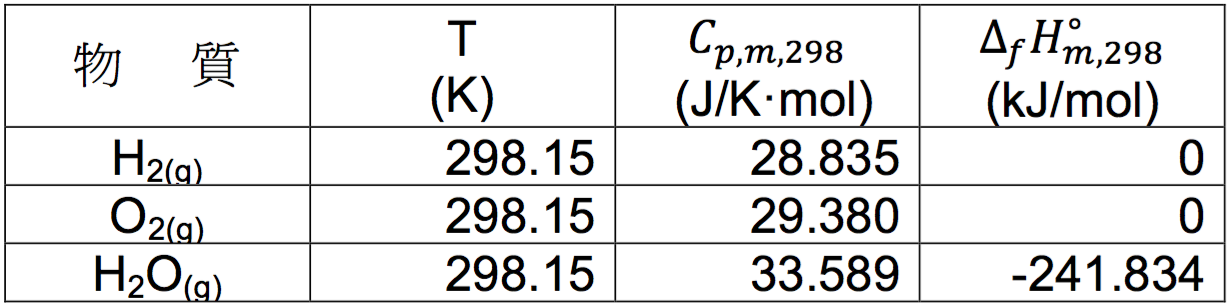
透過網站查表 (httl://www.crct.polymtl.cal/FACT/website.htm),可得溫度為 298.15 K 時,上列各物種的各項熱力學數據,詳如表一。
將表一的焓值代入 $$(2)$$ 式,可得:
$$\displaystyle\Delta_rH^{\circ}_{m,298}=H^{\circ}_{m,298}(\mathrm{H_2O_{(g)}})-0-\frac{1}{2}\times 0=-241.834~kJ/mol$$
由上式可以看出在參考狀態時,即溫度為 298.15 K 時,類似 $$(5)$$ 式的生成反應,因為各反應物均為元素,依規定其相對焓都訂為 $$0$$,此時的莫耳反應焓已如上述,亦為莫耳生成焓,也等於該生成化合物的莫耳相對焓 $$(H^{\circ}_{m,298}(\mathrm{H_2O_{(g)}}))$$。若溫度不是 298.15 K 時,各元素物質的相對焓不為 $$0$$,此時的莫耳生成焓亦不等於該生成物的莫耳相對焓。習慣上,在參考狀態時的列表數據,均將莫耳相對焓以莫耳生成焓 $$(\Delta_fH^{\circ}_{m,298})$$ 表示。
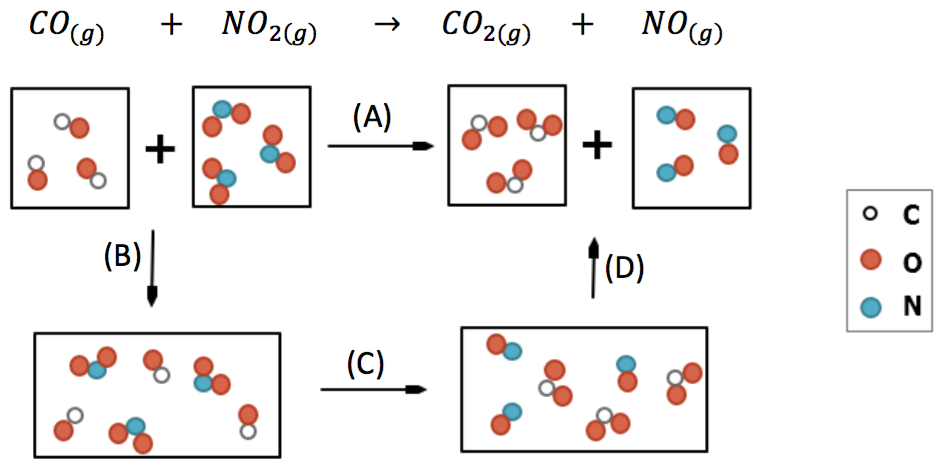
以上的說明,均認定各氣體物質為理想氣體,反應結束時各反應物也完全反應完畢。另外,反應物因混合而產生焓的變化因素,在計算中均排除在外,以圖二在常溫常壓的化學反應式為例:$$\mathrm{CO_{(g)}}+\mathrm{NO_{2(g)}}\rightarrow\mathrm{CO_{2(g)}}+\mathrm{NO_{(g)}}$$,其所歷經的過程應該是 $$\mathrm{CO}$$ 和 $$\mathrm{NO_2}$$ 經過 $$(B)$$ 途徑先混合,在經過 $$(C)$$ 發生反應,生成混合在一起的如 $$\mathrm{CO_2}$$ 和 $$\mathrm{NO}$$。最後以人為的方式,經過 $$(D)$$ 途徑再將生成物彼此分開。
事實上,再計算該反應的反應焓時是直接經由 $$(A)$$ 途徑計算,即 $$\mathrm{CO}$$ 和 $$\mathrm{NO_2}$$ 在未混合時的相對焓各為多少,反應完畢後即使有多個產物,也將其視為各別單獨分開,彼此不混合,再分別計算各生成物的相對焓,最後將生成物的所有相對焓減去反應物的所有相對焓,即可得反應焓,亦為該反應方程式的反應熱。一般學子常會認為所計算的反應焓為 $$(C)$$ 途徑,事實上定義的反應焓卻為 $$(A)$$ 途徑者方為正確,二者不同的地方即為 $$(B)$$、$$(D)$$ 兩步驟的混合及分離焓的變化量,由於焓是狀態函數,因此 $$(A)$$ 的反應焓應等於 $$(B)$$、$$(C)$$、$$(D)$$ 三者反應焓的總和。
三、不同溫度下,標準莫耳反應焓的算法
當反應的溫度不是參考狀態時,例如是 400 K 時,是否也能利用參考狀態的數據,求出相關的數據。首先可以利用表一中給的定壓熱容量,透過下式求出不同溫度下的相對焓:
$$H^{\circ}_{m,400}=H^{\circ}_{m,298}+\int\limits^{400}_{298}C_{p,m,298}dT~~~~~~~~~(7)$$
上式中的定壓熱容量 $$(C_{p,m,298})$$ 若隨溫度改變的量甚小,則在溫度改變不大時,可視為定值,因此上式可改寫成:
$$H^{\circ}_{m,400}=H^{\circ}_{m,298}+C_{p,m,298}\times(400-298.15)~~~~~~~~~(8)$$
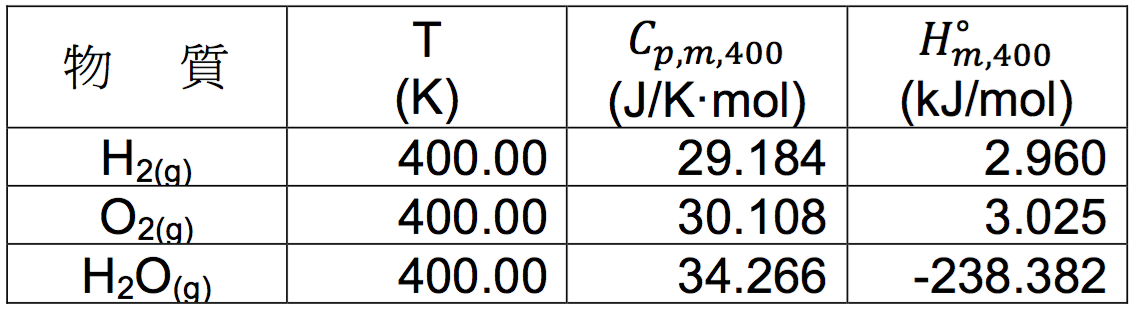
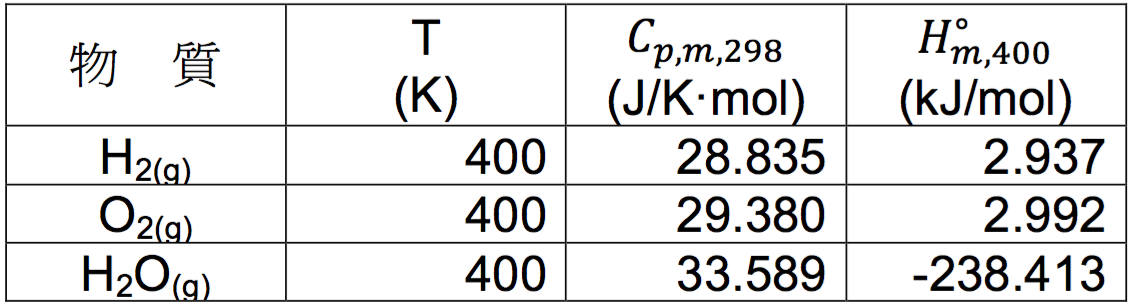
利用 $$(8)$$ 式可將表一的數據換算成表二。
利用表二可以計算 $$(5)$$ 式在 400 K 的反應焓:
$$\displaystyle\Delta_rH^{\circ}_{m,400}=(-238.413)-(2.937)-\frac{1}{2}\times(2.992)=-242.846~kJ/mol$$
由計算出來的莫耳反應焓或生成焓為 $$-242.846~kJ/mol$$,和表二中的水蒸氣的莫耳相對焓 $$(-238.413~kJ/mol)$$ 不同,其原因即為不在參考狀態時元素的相對焓並不等於 $$0$$。
若透過相同網站查表,查詢表二中的各項數據,所得結果如表三,由查表所得出的相關數據和利用表一及(式-8)所得的計算值(表二)相互比較,可看出其相對誤差幾乎可勿略不計。另外,由表二在 298.15 K 時各物種之定壓熱容量和表三在 400 K 時之相對應的熱容量比較,其誤差約為 $$3\%$$,例如水蒸氣在 298.15 K 時為 $$33.589$$,和 400 K 時的 $$34.266$$ 比較,兩者相差不到 $$2\%$$,因此將熱容量視為定值,亦屬合理的範圍。
連結:反應焓的聯想(三)
參考文獻
- Levine, I. N. (1988), Physical Chemistry (3rd ed.), McGRAW-HILL Book Company, p211~225.
- Atkins, P. W. (1994), “Physical Chemistry”, Oxford University Press, Oxford, 5th ed., p. 70~84.
- 炸彈熱卡計 Bomb Calorimeter|加百列的部落格。http://blog.udn.com/Gabriel33/5397627
- Jacobson, N., Journal of Chemical Education, 2001, 78, 814~819.
- 標準莫耳生成焓與相對熵的求法|科學Online。/highscope/?p=70277


 前一篇文章
前一篇文章 下一篇文章
下一篇文章

這大概是我找到最詳細的關於焓的說明,太感謝了!之前為了瞭解焓的定義找了好久啊!但是看完都還是一頭霧水…(我是文組的)。謝謝作者文章的詳細整理與說明!