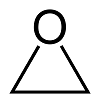
環氧乙烷(Ethylene oxide)(VI)
環氧乙烷(Ethylene oxide)(VI)
台北市立永春高級中學化學科蔡曉信老師 / 國立臺灣師範大學化學系葉名倉教授責任編輯
工業合成(Industrial synthesis)
有關環氧乙烷的商業製造方式要迴溯到1914年BASF公司建立第一座環氧乙烷的生產工廠,他們當時使用氯醇的製程法。但此製程是不具吸引力的,因為它效率低且又使有利用價值的氯氣轉變成氯化鈣,不符合經濟效益。到了1931年由Lefort發明了較有效率的直接用空氣氧化乙烯的方法,並到了1937年由Union Carbide公司率先使用此製程。而到了1958年Shell Oil 公司改良此製程,他們以氧氣來取代空氣並將反應溫度調高到200~300℃、壓力1~3Mpa,這種製程方式到了1975年以後就完全取代舊式的製程。
氯醇法製造環氧乙烷(Chlorohydrin process of production of ethylene oxide)
雖然氯醇法的製程已完全被直接氧化乙烯的方法所取代,但這個方法中所蘊含的知識在教育上有很重要的意義,而且我們仍然使用此方法來製造環氧丙烷。其流程有三個主要步驟:
- 合成乙烯氯醇
- 乙烯氯醇脫去氯化氫形成環氧乙烷
- 純化環氧乙烷,這些步驟是連續性的進行著。在第一個製程管線中進行乙烯的次氯化反應(hypochlorination),其反應步驟如下:
Cl2 + H2O → HOCl + HCl
CH2=CH2 + HOCl → OH–CH2CH2–Cl
CH2=CH2 + Cl2 → Cl–CH2CH2–Cl