化學實驗室實驗:氫氣與氯氣的光化學反應(Photochemical Reactions of Chlorine with Hydrogen)〔II〕
化學實驗室實驗:氫氣與氯氣的光化學反應(Photochemical Reactions of Chlorine with Hydrogen)〔II〕
國立彰化女子高級中學化學科張文平老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之二(Student Handout II)
實驗步驟
C:氫氣與氯氣的光化學反應
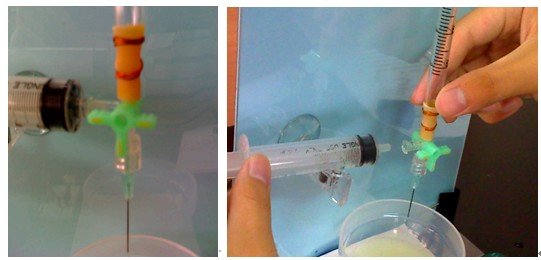
1. 緊密地連接注射筒A與含有橡皮管的注射筒B在一起,如圖十三所示。
2. 連續地推拉針筒推桿(活塞)多次,使兩支注射筒內的氣體儘可能完全混合均勻。然後推進或拉出針筒推桿,使兩支注射筒內的混合氣體體積大約相等。
3. 取下橡皮管,立即分別套上橡皮塞到兩支注射筒開口處。原來注射筒A重新編號為注射筒C,原來注射筒B重新編號為注射筒D。
4. 緊緊地架設注射筒C在鐵架上,以鎳子夾住鎂帶,距離注射筒C的前方約20公分處,如圖十四所示。