標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例(一)
標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例(一)
The entropy difference between the ideal gas and real gas under standard condition – a case study in SO2 (I)
國立臺灣師範大學化學系兼任教師 邱智宏
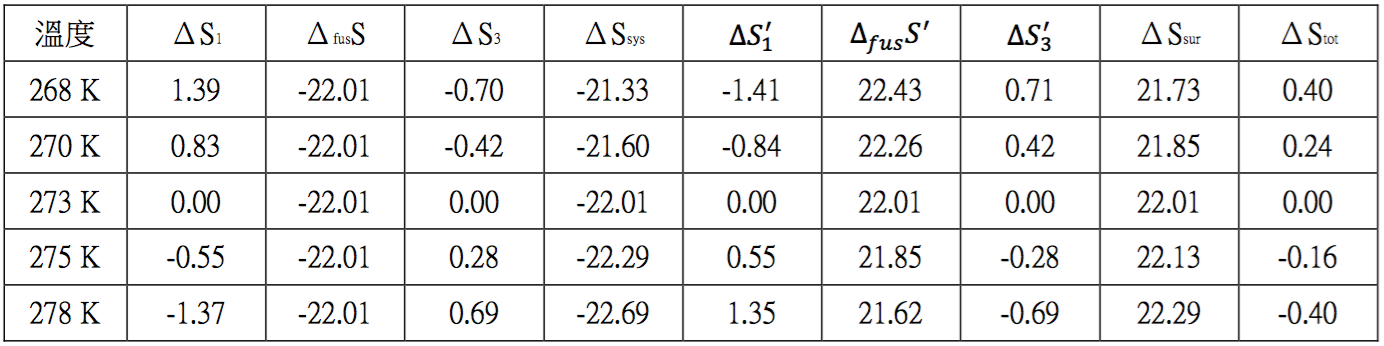
純物質的焓(enthalpy)、自由能(Gibbs free energy)及熵(entropy)是化學熱力學經常要使用到的數據,因此一般化學教科書均會將一些常見物質的相關數據,表列在附錄中,以供參考及使用。但是這些數據是如何求得的?卻鮮少被討論,尤其表列純物質的熵,若在標準狀態下為氣體,則其設定的情況為該氣體為理想氣體。
事實上理想氣體的標準莫耳相對熵$$(S^\circ_{m,id})$$和真實氣體的標準莫耳相對熵$$(S^\circ_{m,re})$$是不一樣的,它們之間的差距是多少?本文擬以 $$\mathrm{SO_2}$$ 為例,利用熱力學的公式,按部就班的推導它們之間的差異,除了讓學子利用所學,真正應用在解決問題上,也期盼學子能感受到在計算過程中數學所扮演的重要角色。