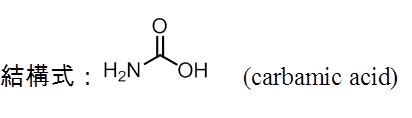氰酸鹽、異氰酸鹽與雷酸鹽(Cyanate、Isocyanate and Fulminate)
國立新莊高級中學陳偉民退休教師
氰酸鹽與異氰酸鹽
氰酸根離子是化學式寫成[OCN]−或[NCO]−的陰離子。在水溶液中可作為鹼,接受質子後生成異氰酸,HNCO。氰酸根離子是多位性牙基(ambidentate ligand),與金屬離子形成錯合物時,無論是氮或氧原子都可能作為電子對提供者。它也可以成為橋配位基(bridging ligand)。在有機物中,若以C-NCO鍵結,稱為異氰酸鹽,其通式為R–N=C=O,如圖1;若以C-OCN鍵結,稱為氰酸酯(cyanate esters)。

圖1 異氰酸鹽
氰酸根離子的三個原子排成同一直線,其路易斯結構可簡單描繪如圖2。其中有C-O單鍵與C-N參鍵。氰酸鹽的紅外線光譜在約2096 cm-1處有一吸收帶,如此高頻是參鍵的特徵。

圖2 氰酸根離子的路易斯結構
當氰酸鹽被酸化時,會產生異氰酸HNCO。雖然根據價鍵理論,異氰酸的結構可以寫成HN=C=O,但在氣相時,其振動光譜在2268.8 cm-1有一個吸收帶,明顯指出C-N必定是參鍵。在價鍵理論中,HN+≡C-O–在共振的混成形式中,佔了重要的分量。純的異氰酸熔點為 -86.8℃,沸點為23.5℃,所以在室溫中有揮發性。在水溶液中為弱酸。
HNCO H+ + NCO– pKa 約 3.7
異氰酸受熱時,會轉化為三聚氰酸(cyanuric acid,如圖3),若繼續加熱,又會再度分解變回異氰酸。烏勒(F. Wöhler)曾經利用異氰酸合成尿素,為史上第一個由無機物製成有機物的反應,若進行該反應之逆反應,

會產生異氰酸,並迅速三聚成為三聚氰酸。

圖3 三聚氰酸
不要將異氰酸鹽與氰酸酯和異氰化物(isocyanide,在有機化合物中又稱為胩)混為一談,這三類化合物的性質非常不同。氰酸鹽(在有機化合物中稱為氰酸酯)的通式為R–O–C≡N,異氰酸鹽的通式為R–N=C=O,二者官能基的連接方向正好相反。異氰化物的通式是R-N+≡C–,與氰酸根相較,其官能基少了氧。