附著力
附著力 (Adhesive Force)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
附著力 (Adhesive Force) 是物質對於不同物質之間的吸引力。相對的,物質對於相同物質彼此的吸引力則是「內聚力 (Cohesive force) 」或稱凝聚力。例如一杯用玻璃杯裝的水,水分子與水分子間有內聚力,而水分子和玻璃分子間存在附著力。
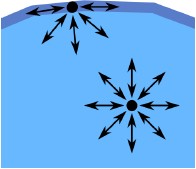
當我們繼續詳細觀察這杯水(圖一),我們會發現:在溶液中的每一水分子受到周圍分子的作用力在每一個方向均相同,且會互相抵消,所以呈現靜力平衡的狀態。但是液體表面之分子,與外界接觸的那一面並沒得到相等的作用力(通常外界為氣體,而液體表面分子受氣體分子的吸引力通常遠小於受液體內部分子的吸引力),導致表面分子受力不均,使得液面的分子有向內的作用力。因此,液體分子傾向於擁有最小的表面積,並可以將最多的分子包圍在溶液裡面。以熱力學的角度來看,假設在液體表面積產生dσ的變化時,所需的功為dw,吾人可以得知:
dw=γdσ
其中γ為表面張力係數(surface tension,為每單位面積的能量變化,標準單位為J.m-2 ,但因為焦耳的定義為牛頓.米,所以亦可以表示之N.m-1)。在標準狀態下(溫度及體積皆無改變時),可以定義物質所具有表面自由能(surface energy)為dA,並且如其它的自由能一般,同樣有令其降低的傾向。
dA=dw=γdσ
由此可得到,當物體的表面積增加dσ時,外界必須對其作至少γdσ的功,以克服表面自由能dA的增加。
如此一來,當外界無法對其作功的時候,物體分子間便會互相聚集,以減少表面積的增加,直到分子之間的距離足夠靠近,分子之間彼此的排斥力抵銷這個作用為止。也因此,只要外界能夠對其作足夠的功,就可以克服這個力量,使得物體產生更多的介面。這些能夠造成做功的則是附著力,附著力可能是分子間的吸引力,如分散附著(dispersive adhesion)當中的凡德瓦力(van der Waal forces):倫敦分散力(London dispersion forces)、德拜力(Debye forces)、基森力(Keesom forces)等等;或者是形成了較強的鍵結,例如化學附著(chemical adhesion)會形成氫鍵,甚至是共價鍵。
附著力和內聚力就像兩個在拔河的隊伍,系統最後呈現的就是兩者角力後的結果。例如:一個分別裝著水銀和水的玻璃杯,水銀和水銀分子及水分子與水分子間以內聚力結合,同時水銀分子和玻璃分子或水分子和玻璃分子也存在著附著力,比較的結果是:水銀分子間的內聚力>水銀分子與玻璃分子間的附著力;但水分子間的內聚力<水銀分子與玻璃分子間的附著力。所以我們觀察到的是水銀表面呈凸起,水面為凹下。
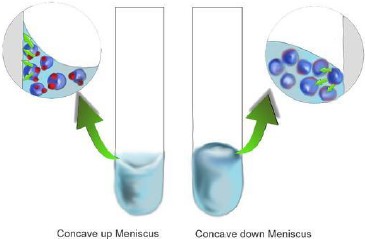
圖二、(左)液體分子與容器壁的作用力(附著力)比內聚力大,液面下凹;(右)液體分子間作用力(內聚力)比附著力大,液面凸起。(圖片來源:http://chemwiki.ucdavis.edu/Phys … And_Adhesive_Forces)
參考資料
1. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; p. 770.
2. Atkins, P. W.; Jones, L. Chemical Principles: the Quest for Insight, 1st edition; W. H. Freeman and Company: New York, 1999, p. 201.
3. Wikipedia—Adhesive force http://en.wikipedia.org/wiki/Adhesive_force
4. Wikipedia—Surface energy http://en.wikipedia.org/wiki/Surface_energy
5. Wikipedia—Surface tension http://en.wikipedia.org/wiki/Surface_tension
6. UC Davis ChemWiki—Cohesive And Adhesive Forces http://chemwiki.ucdavis.edu/Phys … And_Adhesive_Forces


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
