溶液 (Solution)
溶液 (Solution)
國立台灣大學化學系陳藹然博士/國立臺灣大學化學系黃俊誠博士責任編輯
說到溶液你會想到什麼,早上喝的牛奶、果汁,中午喝的玉米湯,實驗室裡的鹽酸或氫氧化鈉水溶液,還是家裡洗衣服用的漂白水。可是到底什麼是溶液?怎麼給溶液下個科學的定義。維基百科說「溶液是由兩種以上物質組成的均勻、穩定的分散體系,被分散的物質(溶質)以分子或更小的質點分散於另一物質(溶劑)中」;百度百科說「溶液是一種或幾種物質分散到另一種物質裡,形成的均一的、穩定的混合物,其中,溶質相當於分散質,溶劑相當於分散劑」;教科書上寫著「溶液是兩種或兩種以上的純物質組成的單相均勻混合物」。三種定義皆強調了兩個重點:第一、溶液是混合物;第二、物質均勻混合或分散在溶液中;但是還有一點必須強調的是此混合物是同相態(Homogeneous)固態、液態或氣態不拘,方可稱為溶液。因為溶液是混合物,所以溶液不像純物質有固定的沸點或熔點;也因為溶液中的溶質均勻分散,沒有懸浮物質或沉澱生成,溶液內任何部分的濃度與性質都相同,等於溶液的整體濃度與性質。
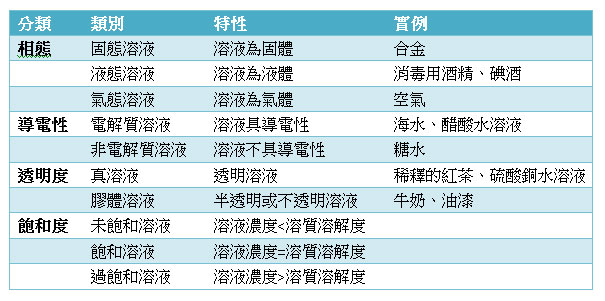
溶液有各式各樣的分類,例如,溶液的相態、溶液的導電性、溶液的透明度和溶質的飽和度等。(表一)
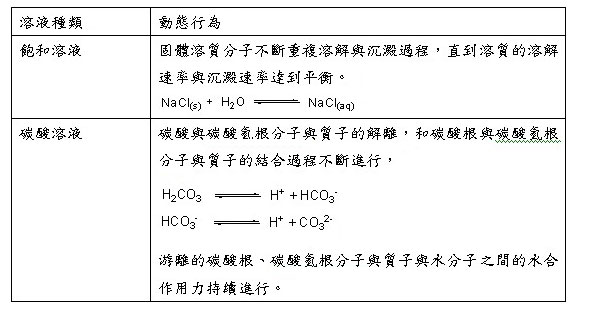
雖然表面看來溶液呈現靜止的狀態,微觀下的溶液系統可是非常忙碌的,溶質分子和溶劑分子不斷的在進行各種動態行為。(表二)
溶液的形成始於溶質溶解的過程,但是物質溶解的機制是一個『化學』還是『物理』反應,長久以來卻眾說紛紜,沒有一個明確的結論。第一個提出溶解是化學機制的科學家是法國化學家貝托萊(Claude-Louis Berthollet, 1748~1822),他在研究埃及鹽湖時,於1789年提出溶解為「溶質與溶液化合」的理論,因為物質溶解會伴隨著熱量變化(吸熱或放熱),還有從水溶液中析出的鹽類物質(硫酸銅等)通常都具有結晶水。當時很多化學家是支持這個理論的,甚至門德列夫Dmitri Ivanovich Mendeleev(1834-1907)和Henry Edward Armstrong (1848 –1937)也分別提出了各自的溶解化學理論。但是溶液的組成不定,不符合化合物的定比定律,而且形成溶液的物質可用簡單物理方式分離,因此,現在普遍認為溶解應該是一個物理過程,沒有化學反應產生。
參考資料:
1. 溶液。http://zh.wikipedia.org/wiki/%E6%BA%B6%E6%B6%B2
2. 溶液。http://baike.baidu.com/view/57905.htm
3. 陳竹亭,選修化學上,泰宇出版社,第74頁,2008.
4. 趙匡華,化學通史,凡異出版社,第529頁,1992.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
