化學
氫氧化鈉(Sodium hydroxide)
氫氧化鈉(Sodium hydroxide)
台灣師範大學化學系葉名倉教授責任編輯
氫氧化鈉(Sodium hydroxide,NaOH)是最常見的強鹼,是化學實驗室的必備藥品之一。氫氧化鈉英文又稱為lye或caustic soda,中文俗稱燒鹼、火鹼及苛性鈉。
丙烯腈(Acrylonitrile)
三硝基甲苯(trinitrotoluene)
三硝基甲苯(trinitrotoluene)
國立台灣師範大學化學系葉名倉教授責任編輯
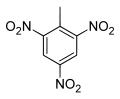
世稱「黃色炸藥」的2,4,6-三硝基甲苯(2,4,6-trinitromethylbenzene)為一種無色或淡黃色晶體,熔點為354 K (178 °F或 80.9 °C),又稱為三硝基甲苯(Trinitrotoluene)或簡稱TNT。TNT帶有爆炸性,由德國化學家Joseph Wilbrand於1863年發明,其結構式如下:
TNT由甲苯經硝化製得,目前多採用三段硝化法。一段硝化中甲苯被硝化成一硝基甲苯(MNT),二段硝化中MNT被硝化成二硝基甲苯(DNT)。三段硝化是將DNT硝化為TNT,需要幾乎不含水的混酸。
精煉的TNT十分穩定,其與硝化甘油(nitroglycerin)不同,TNT對於摩擦、震動等都不敏感,因此它可以存放多年。但TNT遇鹼會發生強烈反應,生成不穩定的化合物。TNT炸藥可產生4.2 MJ/kg的能量,事實上TNT燃燒時比脂肪(38 MJ/kg)和醣類(17 MJ/kg)釋放出更少的能量,但因TNT會非常迅速地燃燒並釋放能量,所以便產生爆炸現象。
乙醯柳酸(Acetylsalicylic acid)
乙醯柳酸(Acetylsalicylic acid)
台灣師範大學化學系葉名倉教授責任編輯
乙醯柳酸(acetylsalicylic acid)俗稱為「阿斯匹靈」(Aspirin),屬於單質子酸,化學式為C9 H8 O4。阿斯匹靈結晶的熔點為138-140℃,可溶於熱水,但幾乎不溶於冷水,溶解度為1 mg/mL (20 °C)。但是阿斯匹靈易溶於乙醇、乙醚及氯仿等有機溶劑中。阿斯匹靈於1897年由拜耳公司研究室的德國化學家霍夫曼(Felix Hoffman)合成,並在1899年正式推出。
合成阿斯匹靈的方法,可由柳酸(salicylic acid)和醋酸酐(acetic anhydride)在酸性觸媒(磷酸或硫酸)或鹼性觸媒(醋酸鈉)的催化下化合而成。再利用阿斯匹靈幾乎不溶於冷水的特性,使其析出白色的晶體,達到純化的效果。
酶(enzyme)
酶(enzyme)
台灣師範大學化學系葉名倉教授責任編輯
酶又稱為酵素,是指具有催化功能的蛋白質。酶所催化的反應速率通常是未催化反應的數十萬倍,甚至達百萬倍。酶催化的原理式通過降低化學反應的活化能來加快反應速率,本身在反應過程中不被消耗,也不影響反應的化學平衡。酶的結構決定了它們的催化活性和機理。接受酶催化的反應物稱為受質(substrates),大多數的酶都要比它們的催化受質大得多,但是酶分子中只有一小部分直接參與催化反應,此小部分可稱為酶的活化中心(active site),此區域通常只由3-4個胺基酸單元(肽)及中心金屬元素所組成。
酶具有高度的專一性(Specificity),只催化特定的反應或產生特定的構型,酶的形狀、表面電荷、親疏水性都會影響專一性。簡言之,酶只對具有特定空間結構的某種或某類受質起作用。
雖然酶是蛋白質,但並非具有生物催化功能的分子都是蛋白質,有一些被稱為核酶的RNA分子同樣具有催化功能。此外,人工酶也具有與酶類似的催化活性。酶的催化活性可以受其他分子影響:酶的活性還可以被溫度、化學環境(如pH值)以及受質濃度等。酶的抑制劑(enzyme inhibitor)可以降低酶活性的分子;酶的活化劑(enzyme activator)則可以增加酶活性的分子。一般情況下,酶在常溫、常壓和中性水溶液條件下可以正常發揮催化活性。在極端條件下,包括高溫、過高或過低pH條件等,酶會失去催化活性。另外也有一些酶則偏好在特定條件下發揮催化功能,如嗜熱菌中的酶在高溫低pH條件下具有較高活性。
草酸鈣與結石(calcium oxalate&kidney stone)
草酸鈣與結石(calcium oxalate&kidney stone)
國立台灣師範大學化學系葉名倉教授責任編輯
人體的腎結石與尿道結石中,有很大的比例是由草酸鈣(CaC2O4, calcium oxalate)所組成。草酸鈣由鈣鹽水溶液與草酸作用而生成,在人尿中也含有少量草酸。草酸鈣為白色晶體粉末,不溶於水及醋酸,但可溶於稀鹽酸或稀硝酸,將其直接加熱可分解變成碳酸鈣或氧化鈣。
腎結石病因可分為原發性、其他疾病及與飲食習慣有關。由於腎結石最常見的成份為草酸鈣,一般人的觀念總以為攝取過量的鈣會加速腎結石產生。然而有充份的證據指出,對許多腎結石患者而言,低鈣飲食和高結石率有闗聯,反之亦然。高蛋白質飲食也可能助長結石。動物性蛋白質分解後成了酸性,要靠骨頭中的鈣來平衡酸鹼度。當血液經過腎臟,濾除廢物時,腎臟會把鈣吸收回來,結果吃越多肉類,腎臟裡的鈣就越多。時間久了,這些鈣若是沒有清掉,就凝聚成結石。
格雷姆定律
格雷姆定律 (Graham’s law )
臺北市立第一女子高級中學二年級鄭竹容/臺北市立第一女子高級中學化學科周芳妃老師/國立臺灣師範大學化學系葉名倉教授責任編輯
氣體粒子在空間中不斷的運動,使得各種氣體粒子可以經由不斷的碰撞而混合均勻,此現象稱為氣體的擴散 (diffusion)。蘇格蘭的物理化學家格雷姆針對氣體擴散的研究,在1833年先提出了非常有名的擴散定律 (law of diffusion)。後來格雷姆又設計實驗測量氣體的逸散 (effusion)性質,即研究氣體在一定的時間內通過小孔出去的速率與氣體分子量的關係,到了1846年又提出逸散定律 (law of effusion)。
格雷姆的實驗結果顯示,在同溫、同壓下,氣體的擴散速率與氣體逸散速率皆與氣體之分子量的平方根成反比,因此氣體擴散定律與氣體逸散定律常被合稱為格雷姆定律 (Graham’s law )。