錯合物的反應
錯合物的反應 (Reactions of complexes)
國立臺灣師範大學化學系碩士班二年級 陳培杰
錯合物的反應有很多種,首先介紹配位基的取代反應 (Ligand substitution reactions),通常一個錯合物會藉由路易士酸來進行取代反應。
$$\mathrm{\text{M-X}+Y\rightarrow \text{M-Y}+X}$$
$$\mathrm{X}$$ 為離去基 (leaving group) 且通常為一種溶劑分子,$$\mathrm{Y}$$ 為進入基 (entering group) 且為一種配位基,舉例來說:
$$\mathrm{[Co(OH_2)_6]^{2+}_{(aq)}+Cl^-_{(aq)}\rightarrow [CoCl(OH_2)_5]^{+}_{(aq)}+H_2O_{(l)}}$$
以配位基取代反應的反應速率來分類,其中反應很快的稱作非惰性 (labile),如:$$\mathrm{[Ni(OH_2)_6]^{2+}}$$ 中的 $$\mathrm{H_2O}$$ 很容易被其他鹼取代,稱為非惰性;反應很慢的稱作為惰性 (inert),如:$$\mathrm{[Co(NH_3)_5(OH_2)]^{3+}}$$ 中的 $$\mathrm{H_2O}$$ 不容易被其他鹼取代,稱為惰性。
會影響反應速率的條件涵蓋很多因素,大致上可分為兩類,第一個是配位場穩定能 (ligand field stabilization energy, LFSE) 較大者比較穩定,為惰性;配位場穩定能較小者比較不穩定,為非惰性,第二個則是較小的離子通常為惰性,因為較小的金屬跟配位基之間鍵結強度比較強、且由於中心原子較小在立體空間較為擁擠,進入基也比較難接近金屬產生鍵結。
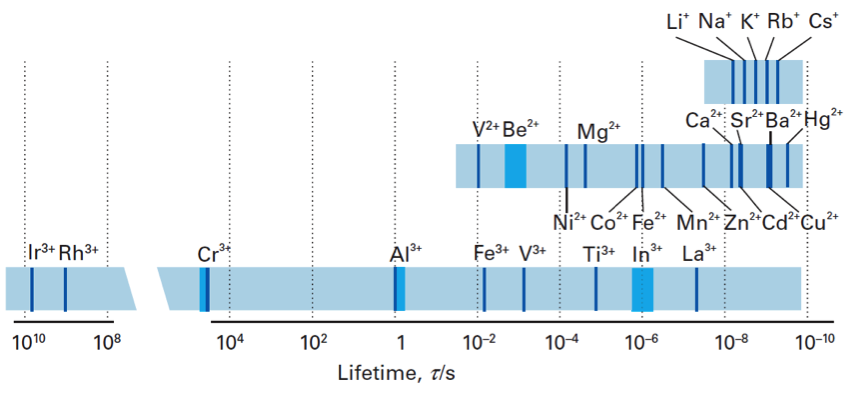
由圖一可歸納下列幾點:
- 具有 $$s$$ 軌域的錯合物(除了最小的 $$\mathrm{Be^{2+}}$$ 和 $$\mathrm{Mg^{2+}}$$)都是非惰性。
- 具有 $$f$$ 軌域的正三價金屬錯合物都是非惰性。
- $$d^{10}$$ 的錯合物通常是非惰性。
- 在 $$3d$$ 軌域系列中的正二價金屬為非惰性,其中的 $$\mathrm{Cu^{2+}}$$ 因為楊恩-泰勒效應 (Jahn-Teller effect, JTE) 的關係變得更非惰性。
- 在具有 $$d$$ 軌域的原子中,正三價金屬比正二價金屬還更為惰性。
- 在具有 $$d$$ 軌域的原子中,如果擁有 $$d^3$$ 或低自旋 $$d^6$$ 的組態時(如:$$\mathrm{Cr(III)}$$、$$\mathrm{Co(III)}$$、$$\mathrm{Fe(II)}$$)通常為惰性,因為其具有較高的配位場穩定能;或是具有相同組態的錯合物 $$\mathrm{([Fe(phen)_3]^{2+})}$$ 也為惰性。
- 具有 $$4d$$ 或 $$5d$$ 軌域的原子因為其具有較高的配位場穩定能及較強的金屬配位基鍵,所以較為惰性。
再來,介紹下列三種親核取代反應的機制,分離 (dissociation)、結合 (association)、交換 (interchange):
- 分離,通常用 $$D$$ 表示,其反應在中間體時,因為離去基的離去而使原本的錯合物配位數降低:
$$\mathrm{ML_nX\rightarrow ML_n+XML_n+Y\rightarrow ML_nY}$$ - 結合,通常用 $$A$$ 表示,其反應在中間體時,因為進入基先加成而使原本的配位數高於原本錯合物的配位數。
$$\mathrm{ML_nX+Y\rightarrow ML_nXYML_nXY\rightarrow ML_nY+X}$$ - 交換,通常用 $$I$$ 表示,其反應因為中間體不易被發現,所以通常只有一步反應。
$$\mathrm{ML_nX+Y\rightarrow X\cdots\cdots ML_n\cdots\cdots \rightarrow ML_nY+X}$$
那麼要如何去分辨結合跟交換的機制呢?這兩個機制取決於其中間體被分離出來並在不同條件或反應下,是否能長時間存在且被偵測;若中間體可被偵測,那就是結合的機制。我們也可以利用觀察進入基在產物的位置,因為中間體的存活時間夠長,便有機會進行重排、進入基有可能從不同的位置進入,可能得到立體化學相同或不同的產物。但是當一個錯合物發生取代反應時,進入基必會產生,得到與起始物相反的立體化學結構。
參考文獻
- Atkins, P. (2010). Shriver and Atkins’ inorganic chemistry. Oxford University Press.
- Tobe, M. L., & Burgess, J. (1999). Inorganic reaction mechanisms. Longman.
- Henderson, R. A. (1992). Kinetics and mechanism of reactions of transition metal complexes: Ralph G. Wilkins, VCH, Weinheim, 1991.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
