金(Gold)的性質
金(Gold)的性質
國立林口高級中學化學科林明祥老師/國立台灣大學化學系陳藹然博士責任編輯
金是眾人最熟知的貴重金屬,在地殼中的含量約 5×10−7 %。金在自然界通常以元素態存在,大多是金塊或是金片,除此之外,金還能以純金岩脈或鍗化物礦物形式存在,通常存在於石英礦和黃鐵礦附近。由於金性質穩定,自古以來被當做貨幣和保值物品,至今每年的開採量超過2500噸,年再回收量也超過4000噸。其實在海洋中也存在大量黃金,不過濃度非常小(50–150 fmol/L),開採需花費大量成本,經濟價值低。
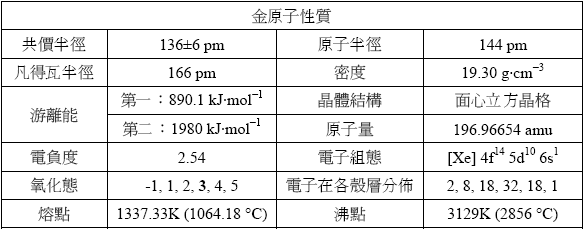
金的元素符號為Au,源自拉丁文「aurum」一詞,意思為閃亮的曙光。金原子序為79,位在元素週期表第11族(1B)、第六週期,屬於過渡金屬。其它關於金的資料,整理如下:
就物性而言,金有很強的金屬性,如延展性佳、易導電、導熱。金是所有金屬中,延展性最好的物質;根據推算,一盎司的金(28.3495克)可壓延成300平方英尺(8.5平方公尺)的薄片,換句話說,一萬片金葉疊在一起僅有一公釐的厚度。因為金能反射紅外線輻射,因此可以將金膜塗抹在太空船表面或旅館的大窗玻璃以防止過熱。大部分的金屬光澤為銀色或灰白色,不過金卻呈現美麗的金黃色,令人驚異的是,當金粒子為奈米級大小卻呈現紫色到紅色。
金的化學性質安定,不易與其它物質發生反應,連強氧化劑如濃硝酸也無法將它溶解,只有濃硝酸輔以鹽酸提供足夠的氯離子使被氧化的金形成穩定的四氯金錯離子(AuCl4-)才能溶解金,這種硝酸與鹽酸的混和物(體積比1:3)稱為王水。金雖然不活潑,但是依然可以形成多種化合物。其中金所可以呈現的氧化態為-1~+5。其中以+1與+3兩種氧化態最常見。舉列來說,金在鹵化物、硫化物和氰化物中以+1氧化態存在。+1氧化態金的化合物容易還原成金屬金,工業上常用NaAu(CN)2化合物將金鍍在其它金屬物質上。冶金工業上則常使用金於氧氣中可溶於含有氰離子溶液來提煉金,再用鋅將提鍊出的金溶液還原為金塊,反應式如下:
+3氧化態金的化合物中最常見的為氯化金(III),AuCl3。此外,金(I)的錯合物其配為數通常為二,形成直線形的錯合物;而金(III)錯合物配位數為四,涉及d軌域的混成,而形成平面四方形的錯合物。
金同位數多達36種(原子量從169~205),其中以金-179最穩定,含量最多(幾乎占100%),其餘同位素皆為人工合成,且具有放射性。其中以金-195半生期最長,約186天;而以金-171最短,約只有15 us。金-198目前已用於治療癌症,半生期約2.7天,金-198可藉由在核反應爐中用中子流轟擊金-197而得。
參考資料:
1. 曾國輝,《化學(下冊)第二版》,藝軒圖書出版社,第982頁至第988頁,2001年1月。
2. Albert Stwertka著,劉廣定 增訂,《化學元素導覽》,世潮出版社,第176頁至第178頁。2004年8月
3. WIKIPEDIA網站-GOLD http://en.wikipedia.org/wiki/Gold
4. Cambridge Crystallographic Data Centre網站– Element Name List
http://www.ccdc.cam.ac.uk/products/csd/radii/table.php4


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
