還原劑
還原劑 (Reducing Agent)
國立臺灣大學化學系黃俊誠博士/國立臺灣大學化學系陳藹然博士責任編輯
還原劑是指在氧化還原反應中,擔任電子提供者的角色,也就是在反應中它本身被氧化,同時還原另一個反應物。例如下列亞鐵離子和氯氣的反應: Fe2+ + ½Cl2 → Fe3+ + Cl–(eq 1) 還原試劑是為Fe2+,它提供一個電子而轉變成Fe3+,同時間氯氣被還原成負一價的氯離子(Cl–)。
在有機化學中,「還原」是指碳原子的氧化數(oxidation number)價數減少,如含不飽和碳化合物的氫化反應(hydrogenation)。C6H6+ 3 H2 →C6H12 (eq 2) 苯(C6H6,benzene)在鉑金屬的催化之下和氫氣反應產生環己烷(C6H12,cyclohexane),原本苯的碳的氧化數是-1,氫化後的環己烷的碳的氧化數變成-2,減少了1,所以氫氣是還原劑且提供電子給苯。
什麼才是強還原劑?
愈容易提供電子的物質還原能力愈強,也就是強還原劑。以元素為例,原子半徑愈大的元素,因價電子距離原子核較遠,所以這些電子較不被原子核束縛,較容易失去電子,電負度低,游離能也較小,因此視為強還原劑,例如活潑的金屬,鈉、鉀、鈣、鋇、鎂…等。另外,金屬的氫化物,如氫化鈉(NaH)、氫化鈣(CaH2)…等,可提供帶負電的氫離子(H–,hydride),也是強還原劑。
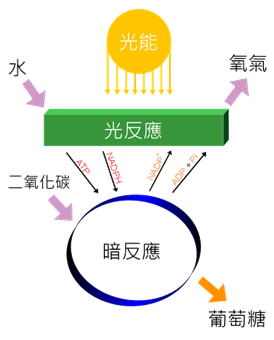
有些化合物或元素可當還原劑亦可作為氧化劑。例如,氫氣與氧氣或氟反應時,是擔任還原劑角色(eq 3);與金屬反應時,卻變成氧化劑 (eq 4)。 H2 (還原劑) + F2 → 2 HF (eq 3) H2 (氧化劑) + 2 Na → 2 NaH (eq 4) 植物行光合作用(Photosynthesis)是日常生活中常見還原反應實例 (eq 5)。在反應中,需要酵素(enzyme)與葉綠素將陽光轉換成化學能量。其中,CO2被還原成碳水化合物((CH2O)n,carbohydrate),H2O被氧化成O2 (圖一)。 CO2 + 2 H2O + 陽光 → (CH2O)n + H2O + O2 (eq 5)
其他日常生活中常見還原劑:焦煤、氫氣、一氧化碳、二氧化硫(SO2,sulfur dioxide)等。高爐煉鐵時,焦炭將氧化鐵中的鐵還原(eq 6-8)。二氧化硫是個很好的還原劑,在城市的污水處理中,二氧化硫用來處理排放前的氯化污水:二氧化硫與氯氣反應,氯氣被還原,生成Cl–。
此外SO2常用於漂白動物織品原料、稻草和羽毛,亦用於糖的精製及蔬果的保存,但有致癌之虞。
Fe2O3(s) + C (s) → 2 Fe3O4(s) + CO (g) (eq 6)
Fe3O4 (s) + CO (s) → 3 FeO (s) + CO2 (g) (eq 7)
FeO (s) + CO (s) → Fe (s) + CO2 (g) (eq 8 )
參考資料:
1. Reducing agent. http://en.wikipedia.org/wiki/Reducing_agent
2. Sulfur dioxide. http://en.wikipedia.org/wiki/Sulfur_dioxide
3. Photosynthesis. http://en.wikipedia.org/wiki/Photosynthesis
4. J. W. Hill, General Chemistry, 4th ed., 2005, Prentice-Hall.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
