滲透壓(一)
滲透壓 (Osmotic Pressure)(一)
東京大學理學博士陳藹然/國立臺灣大學化學系黃俊誠博士責任編輯
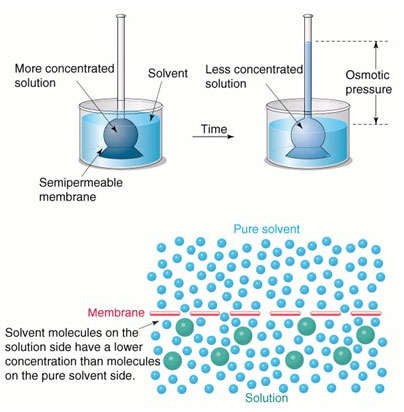
當一張半透膜 (Semipermeable membrane)隔開溶液和純溶劑或兩種不同濃度的溶液時,因為半透膜兩側的濃度不同,即膜兩側單位體積的溶劑分子數不同,溶劑分子移動至高濃度側的速度比從高濃度溶液移動至低濃度側的速度大,導致高濃度端的液面開始上升,且原先高濃度側的溶液濃度因此稀釋。當液面升至某一高度就會停止上升,因為液面高度所增加的液壓差稱為「滲透壓 (Osmotic pressure)」。(圖一)
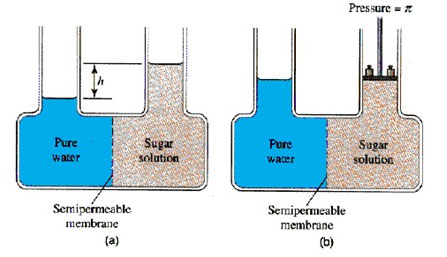
滲透壓抑制了溶劑分子在半透膜兩側來回的靜移動,也就是系統達到了平衡,溶劑分子移動至高濃度側的速度和從高濃度溶液移動至低濃度側的速度相同。溶劑移動至高濃度溶液滲透現象可以外在加壓的方式得到抑制(圖二),此時高濃度溶液上所加的壓力等於此溶液的滲透壓。
滲透壓和溶液的濃度有關,可表示為eq 1。此方程式又稱「凡特何夫方程式」。
П = CMRT (eq 1)
П:滲透壓,CM:體積莫耳濃度,R:理想氣體常數 = 0.08206 L•atm/K•mol,T:絕對溫度。
滲透壓是很大的,即使是在稀薄溶液的滲透壓。舉例來說,0.15 M的氯化鈉水溶液在25℃時的滲透壓是7.3 atm,相當於250英尺的水柱。滲透壓大小和溶液中的粒子數有關,有專用的單位osmolarity(osmol),1 溶液等於1莫耳完全溶解的離子或非電解質分子在每升溶液中的滲透壓。譬如0.5 M蔗糖溶液的滲透壓是0.5 osmol,但是0.5 M氯化鈉水溶液的滲透壓卻是1.0 osmol,這是因為0.5 M氯化鈉溶液包含1.0 M離子和(0.5 M 氯離子和0.5 M 鈉離子)。
請參考 滲透壓 (Osmotic Pressure)(二) 閱讀
參考資料
1. 陳竹亭,選修化學上,泰宇出版社,第74頁,2008.
2. John McMurry, Mary E. Castellion, David S. Ballantine; “Fundamentals of General, Organic, and Biological Chemistry”, 5th edition, Pearson, pp. 282, 2007.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
