軟硬酸鹼學說
軟硬酸鹼學說(Hard and Soft Acids and Bases)
國立臺灣師範大學化學系三年級 趙崇瀚
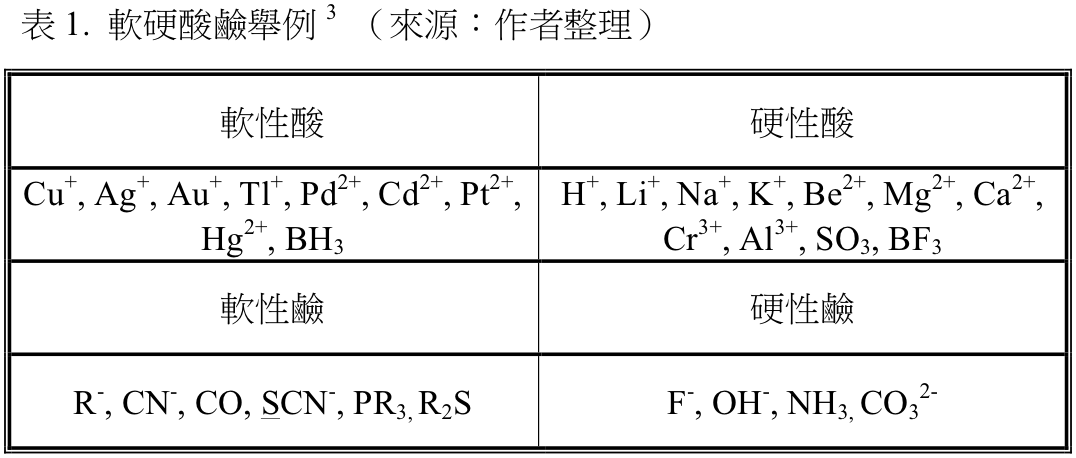
軟硬酸鹼學說 (Hard and Soft Acids and Bases, HSAB) 是於 1963 年,美國科學家拉爾夫 G. 皮爾森(Ralph G. Pearson,圖一)所提出一種對於路易士酸鹼的定性描述,其內容在於將路易士酸及路易士鹼分為「軟」及「硬」兩類,再依循「軟的路易士鹼偏向與軟的路易士酸反應、硬的路易士鹼偏向與硬的路易士酸反應」此一原則,來討論路易士酸鹼反應的趨向、產物的穩定性。1
所謂「軟」的酸、鹼,是指主要以共價鍵形式與其他酸鹼鍵結的路易士酸鹼。此種酸、鹼的分子通常較大、容易被極化,若是以離子性的模型去推測、計算這類酸鹼反應的相關數值時會有較大的偏差。而「硬」的酸鹼則是指主要以離子鍵形式與其他酸鹼鍵結的路易士酸鹼,其通常較小、電荷密度大而不易被極化,以離子性的模型去推測其性質能較符合實際情況。
若是要將一路易士酸、鹼分為軟或硬,可以藉由比較其與不同酸鹼反應所得產物之穩定性來達到此目的。例如:要判斷一路易士酸是軟或硬時,可以比較該酸與不同鹵素反應的平衡常數,若是平衡常數大小為 I– <Br– < Cl– < F–,則可將該酸分類為硬的酸(在鹵素中,氟離子電荷密度高,相對較硬。而碘離子電荷密度低、較易極化,相對較軟),反之亦然。
透過這種比較的方法,我們能夠得到一個趨勢:通常體積越大的酸鹼越軟,越小的則越硬。然而,仍會有其他因素影響路易士酸鹼的軟硬性,像是許多含碳的路易士鹼,雖然電子團體積不大,但是卻是屬於軟的路易士鹼。例如:CO、CN–,都是屬於軟的鹼。由於其LUMO(π* 軌域)的能量夠低,因此其在做為鹼提供酸電子的同時,也能夠接受來自酸本身的電子,此時雙方共用電子的概念就像是共價鍵一般,說明了其為軟性鹼的原因。因此酸鹼本身的大小與其軟硬的關係只是一個大方向的趨勢,除了考慮電荷密度不同影響鍵結的共價性、離子性之外,酸鹼本身的性質(如上述的軌域,彼此鍵結所受到的立體障礙、產物的穩定性…等)及其他外在因素都有可能影響酸鹼的軟硬性。
有些路易士鹼則有可能同時具備軟及硬的性質,最著名的例子是硫氰酸根離子(SCN–)。因為硫原子及氮原子上都具有孤電子對,能夠做為路易士鹼,若是其與較軟的酸反應則會以較軟的硫端和酸形成鍵結,反之則是以較硬的氮端接上路易士酸。
軟硬酸鹼學說能夠解釋許多現象,例如在自然界中原子半徑小的金屬(如Li, Mg)大多是以氧化物的形式存在,然而原子半徑較大的過渡金屬(Fe, Pb)大多是和硫化物的形式存在,其差別就在於氧離子較硬、硫離子較軟,所以我們所觀察到的陰陽離子配對方式即是經過長時間平衡後所呈現的結果。
參考文獻
- Atkins, P. W., Overton, T. L., Rourke, J. P., Weller, M. T. & Armstrong, E. A. (2009) Inorganic Chemistry. W. H. Freeman and Company.
- HSAB theory — wikipedia. http://en.wikipedia.org/wiki/HSAB_theory
- Hard and Soft Acids and Bases — Chemwiki. http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Coordination_Chemistry/Hard_and_Soft_Acids_and_Bases
- Ford, P. C. (1999) Interview with Ralph G. Pearson. Coordination Chemistry Reviews 1999, 187, 3-15. doi:10.1016/S0010-8545(98)00223-9.



 前一篇文章
前一篇文章 下一篇文章
下一篇文章
