路以士結構I(Lewis structure I)
路以士結構I(Lewis structure I)
高雄市立高雄高級中學化學科陳藝菁老師/國立中山大學化學系張祖辛副教授責任編輯
路以士結構(Lewis structures)也被稱為路以士點圖(Lewis-dot diagrams)、電子點圖(Electron-dot diagrams)或電子點結構(Electron-dot structures),用以表示分子中的原子鍵結及可能存在的孤對電子。路以士結構能用以描繪共價鍵結分子和配位化合物(coordination compounds)。1916年,路以士(Gilbert N. Lewis)於「原子與分子」(The Atom and the Molecule)的文章中,開始使用這種圖示法。路以士結構與電子點圖相似,但路以士結構是以線表示原子間的共用電子對,以電子點表示孤對電子,當共用電子為一對時以單線表示,兩對時以雙線表示…。路以士結構顯示出分子結構中毎一個原子的相對位置,原子間以線連結(也可用一對點表示),多出來的孤對電子則以一對、一對的點形式畫在原子旁。
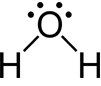
路以士結構中的電子總數即是分子中所有中性原子價電子數的和。當分子的價殼層有八個電子時,無論這些電子是否參與鍵結,分子都會特別穩定,此即為八隅體法則(octet rule)。這個法則適用於酸性化合物。但由第四週期起,原子更適宜用18電子法則(18-Electron rule)。18電子法則是指軌域中的價電子數達18個時,其電子組態與惰性氣體的電子組態相同,分子會特別穩定。而更後面的第六週期起,則又有類似的32電子法則。除了有機化合物,僅有少數化合物能滿足八隅體。第2與13族(如鈹(beryllium)、硼(boron)和鋁(aluminium))的化合物,其中心原子的價電子數,常不足八個;第15到18族(如磷(phosphorus)、硫(sulfur)、碘(iodine)和氙(xenon))的化合物,其中心原子則常見超過8個的情形,被稱為超價(hypervalent)分子。
描繪路以士結構時,首要便是計算價電子個數,算出分子中全部價電子總數後,接著便是將電子呈現於結構中。呈現電子的步驟首先為標示孤對電子於較外層的原子,使其鍵結電子與孤對電子數能達八個,接著將剩下的孤對電子置於中心原子。若有懷疑,則先將孤對電子置於陰電性較高的原子上。當所有的孤對電子置好後,有些原子(尤其是中心原子)可能並未滿足八隅體,這時原子間必須形成雙鍵,所以移動孤對電子在兩原子間形成第二條鍵。當兩原子共用鍵結電子時,原帶有孤對電子的原子仍滿足八隅體,而原未滿足八隅體的原子則在價殼層中增加兩個電子。多原子的離子團也以相同方法描繪,但計算電子時帶負電的離子需將多出的電子置入結構中;帶正電的離子則因比中性原子少電子,而需扣除電子。繪圖時將離子結構置於括號中,而將價數以上標方式標示於括號外右上角。還有另一種較簡單的路以士結構建構法,則是先算出各原子的價電子數,將原子間的價電子成鍵,陰、陽離子則先繪出中性分子後,再由適當的原子增加或抽去電子。此建構法可配合鍵數的計算而快速得出其結構。其中的訣竅是算出分子中每個原子滿足八隅體所需的總電子數(H只需2個電子)與分子的總價電子數間的差值,此差值即是成鍵的電子數。繪出鍵結後,剩餘的價電子則以孤對電子的形式補滿原子,使原子滿足八隅體。
註:Lewis有時譯為路易斯。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章

感謝老師的分享。這對於我正在於美國大學修讀的「基礎化學」課程很有幫助!