薗頭耦合反應
薗頭耦合反應 (Sonogashira Cross-Coupling)
國立臺灣師範大學化學系碩士生洪嘉駿
耦合反應通常以有機金屬化合物(organometallic compound)作為催化劑來參與反應使得鹵化烴相互鍵結,最常被人使用的是鈀金屬化合物。鈀金屬作為催化物的耦合反應現在仍被熱烈的研究著,因為其應用非常廣泛。在某些藥物合成上也是不可或缺的反應步驟,例如可治療乾癬的外用維他命A酸:tazarotene。
以鈀金屬催化的合成方法到目前為止已發展出許多有名的反應,例如:Heck 反應(烯烴與芳香鹵化物耦合)、Sonogashira反應(芳香鹵與炔烴耦合)、Suzuki 反應(芳香鹵與烷基硼酸耦合)…等等。
這些利用鈀金屬化合物作為催化劑的反應中以四(三苯基磷)鈀,$$\mathrm{Pd(PPh_3)_3}$$、二氯雙(三苯基磷)鈀,$$\mathrm{Pd(PPh_3)_2Cl_2}$$、乙酸鈀,$$\mathrm{Pd(OAc)_2}$$ 和 $$[1,1′-$$雙(二苯基磷)二茂鐵$$]$$二氯化鈀,[1,1′-Bis(diphenylphosphino)ferrocene]dichloropalladium(II) 這四種最為常見且都為已商業化的市售粉末狀試劑。
Sonogashira 反應於 1975 年由 Kenkichi Sonogashira(健吉薗頭)、Yasuo Tohda 和 Nobue Hagihara 發表,並以健吉薗頭的姓來命名。此反應除了與其他反應同樣使用有機鈀金屬作為催化劑外,還在鹼性環境下使用了碘化銅作為副催化劑,除了鈀循環外還多了銅循環一起共催化(cocatalys)
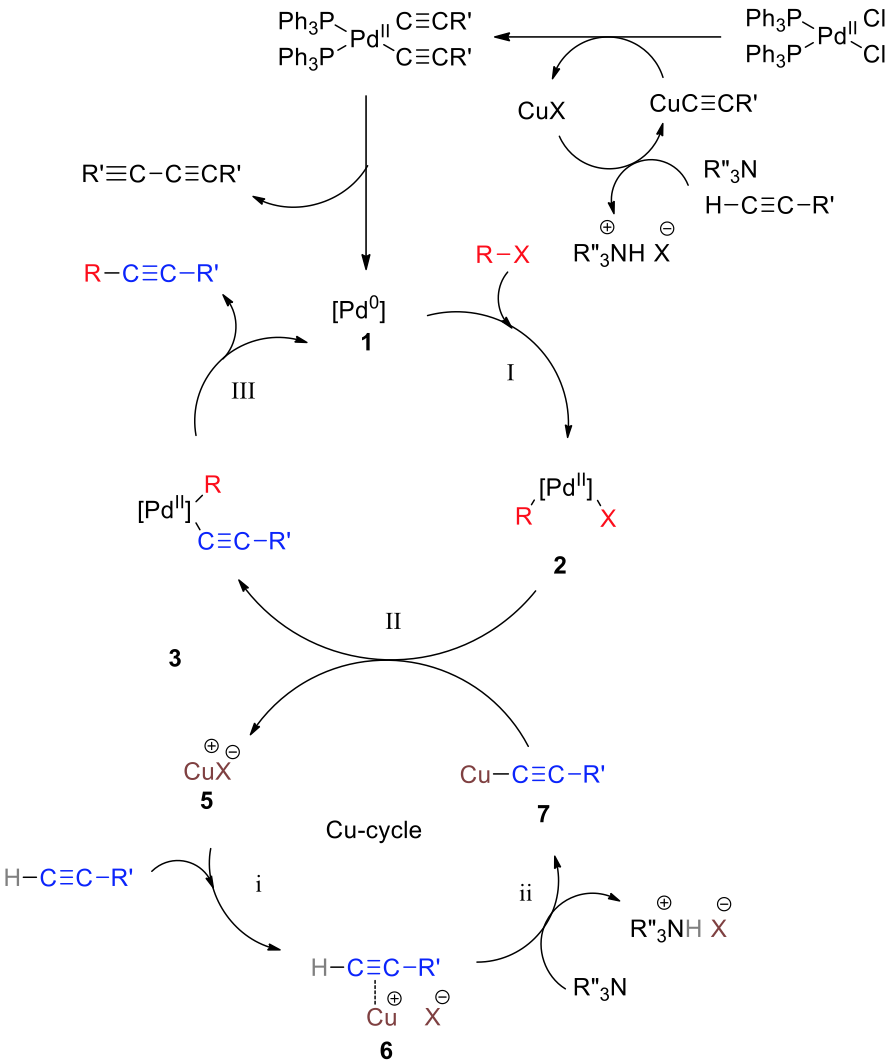
Sonogashira反應涉及了兩個反應循環:銅循環和鈀循環
銅循環
- 鹵化亞銅 $$5$$ 與炔的 $$\pi$$ 電子配對形成錯合物 $$6$$ 使得末端炔上的氫酸性增加。
- 通常胺因鹼性不足的緣故無法將末端炔上的氫拔走,但在此銅循環中作為溶劑的胺將酸性較高的末端炔氫置換,最後反應走向一價銅的亞銅炔錯合物 $$7$$。
鈀循環
因為可以在實驗室較長時間儲存的關係,通常實驗室會採購二價鈀化合物作為預催化劑。低活性二價鈀首先先被 n-electron donor 化合物(分別作為取代基和溶劑的磷化氫和胺)還原成化合物 $$1$$─高活性的零價鈀,接著:
- 化合物 $$1$$ 與芳香烴基(或烯基)發生氧化加成反應,生成二價鈀錯合物 $$2$$。
- 錯合物 $$2$$ 與銅循環中的亞銅炔錯合物 $$7$$ 發生金屬交換反應。
(transmetalation),末端炔基轉移到鈀金屬上形成新鈀金屬錯合物 $$3$$,研究認為此金屬交換步驟為速率決定步驟。原先的亞銅則變回鹵化亞銅,$$5$$,繼續參予銅循環,和其他末端炔反應下去。 - 最後錯合物 $$4$$ 經過還原消除反應之後得到耦合產物,鈀金屬繼續參予其他鈀循環。
在鈀金屬催化發展成熟到可以有效利用前,因為鹵化烯較不活潑之故,傳統方法下很難將之用於取代反應,但在發展出許多可以用少量鈀金屬催化耦合的方法後,對於天然物合成和醫藥合成方面將會有更多的發展空間。
參考資料
- Chinchilla, R.; Najera, C., The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry, Chem. Rev. 2007, 107, 874-922.
- Chinchilla, R.: Najera, C., Recent advances in Sonogashira reactions, Chem. Soc. Rev. 2011, 40, 5084-5121.
- Sonogashira, K., Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides, J. Organomet. Chem. 2002, 653, 46-49.
- Sonogashira, K., Tohda, Y., Hagihara, N., A convenient synthesis of acetylenes: catalytic substitutions of acetylenic hydrogen with bromoalkenes, iodoarenes and bromopyridines, Tetrahedron Lett. 1975, 16, 4467-4470.


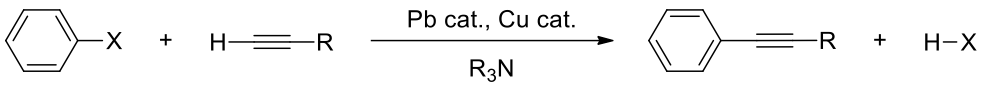
 前一篇文章
前一篇文章 下一篇文章
下一篇文章
