自催化反應(Autocatalysis)
自催化反應(Autocatalysis)
台北縣立三民高級中學化學科莊麗紋老師/國立台灣大學化學系陳藹然博士責任編輯
在化學反應中,能改變反應速率而本身的組成和質量在反應後保持不變的物質,稱為催化劑。如果一個反應,它的反應產物能提高該反應速率,即反應產物能起催化作用,這個反應就被稱為自催化反應(autocatalysis)。
假設有一個二級自催化反應A + B→ 2B
反應速率方程式為 R=k [A][B]
A和B的濃度隨時間變化為
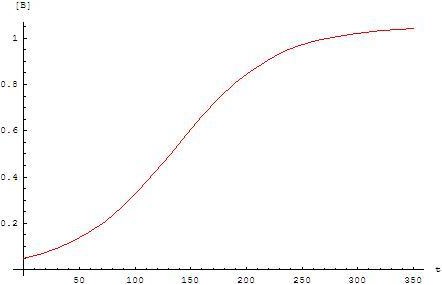
典型的自催化反應等式圖形是雙彎曲函數(圖一):反應起初進行地很慢,因為幾乎沒有催化劑存在。反應速率隨着反應進行,產物增加同時催化劑量增加而反應速率加快,最後隨着反應物濃度降低而反應速率減慢。
例如:過錳酸鉀(KMnO4)在酸性條件下的氧化反應(式一),其產物二價錳離子(Mn2+)正好是該反應的催化劑。開始時反應速率較慢,隨著反應中產物二價錳離子的增加,反應速率將越來越快。所以,經常在反應開始時加入少量的二價錳離子以誘導反應發生。
5 Fe2+(aq) + MnO4-(aq)+8 H+(aq) →5 5 Fe2+(aq) + 2 Mn2+(aq)+ 4H2O(l) (式一)
將稀釋的過錳酸鉀溶液分別倒入兩杯草酸(H2C2O4)溶液中(圖二A),其中右邊的燒杯加入些許的硫酸亞錳,硫酸亞錳中的亞錳離子加速氧化還原的進行,使得過錳酸根較快速地轉換成亞錳離子(圖二B),另一燒杯初始並沒有立即褪色,但隨著扮演催化劑的產物亞錳離子的增加,自催化即發生,仍使過錳酸鉀還原的速率越來越快(圖二C)。
圖二B、右邊的燒杯加入些許的硫酸亞錳,硫酸亞錳中的亞錳離子加速氧化還原的進行。
圖二C、隨著扮演催化劑的產物亞錳離子的增加,自催化即發生使左邊的過錳酸鉀還原的速率越來越快。
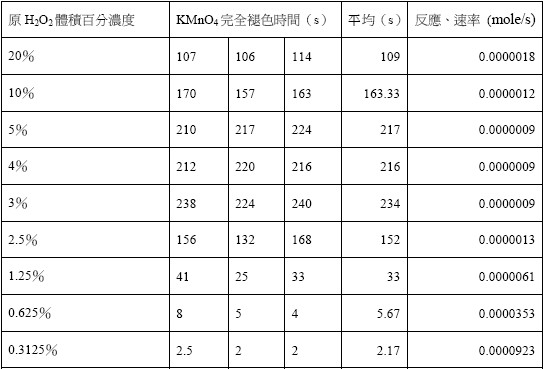
另一個自催化反應的例子為過錳酸鉀與雙氧水(H2O2)的氧化還原,產物亞錳離子一樣具有催化過錳酸鉀還原的效果。由表一中得知當雙氧水的濃度≥2.5%,過錳酸根褪色的時間明顯變長,乃是亞錳離子與雙氧水產生錯合物 Mn(H2O2)n2+,降低自催化的現象。而當雙氧水濃度<1.25% 自由的亞錳離子便能進行自催化反應,反應速率顯著變快(表一)。
表一、雙氧水與0.04M過錳酸鉀反應完全褪色所需時間
參考資料:
1. http://zh.wikipedia.org/zh-tw/自催化反應 (圖一)
2. Jce online–Autocatalysis: Reaction of Permanganate with Oxalic Acid http://jchemed.chem.wisc.edu/JCE … N/AUTOCAT/PAGE1.HTM (圖二)
3. 作者:蘇裕仁、李勁宏、雷詠淳、王怡蘋,指導老師:林秀蓁、莊麗紋,〈高中化學科展:氧生之道〉,台北縣立三民高級中學。





 前一篇文章
前一篇文章 下一篇文章
下一篇文章
