胰臟內分泌及外分泌組織共存的重要性
胰臟內分泌及外分泌組織共存的重要性(The essential coexistence between endocrine and exocrine tissue in pancreas)
國立臺灣大學生命科學系范姜文榮編譯/國立臺灣師範大學生命科學系李冠群教授責任編輯
編譯來源:発生段階で膵臓の外分泌組織を欠くマウスは、糖尿病になる
~機能的膵島作製における外分泌組織との共存の重要性~
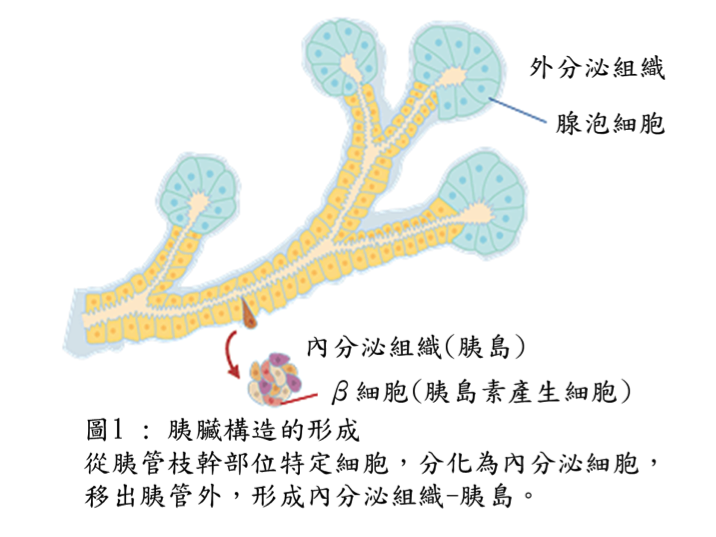
胰臟為一內分泌及外分泌組織共存器官,內分泌組織釋放糖類代謝調節激素-胰島素(insulin)和升糖素(glucagon)至血液,外分泌組織釋放含有多種消化酵素的胰液至腸道。過去發生學研究,雖瞭解胰臟在發育時期,會形成如樹枝狀分叉的胰管(pancreatic duct),其尖端部分形成外分泌組織時,枝幹部分幾乎同時形成內分泌組織(圖1),但兩者交互關係不甚瞭解。
日本京都大學的研究團隊希望能藉由多能性幹細胞(iPS cells)製作機能正常的胰島細胞(內分泌組織),應用於糖尿病(diabetes)治療;並提出若想製作機能較佳的胰島細胞,需在發育過程同時製作外分泌細胞的假說。
為驗證該假說,該研究團隊製作胰臟外分泌組織極少的基改小鼠,以研究對胰臟內分泌細胞形成所產生的影響。蛋白質Pdx1是胰臟發育的必要轉錄因子,研究團隊製作Pdx1基因剔除小鼠,該鼠僅在合成彈性蛋白酶(elastase)的胰臟外分泌細胞基因Pdx1表現上受到抑制。該基因剔除小鼠子代,在出生後前幾天與基因Pdx1表現正常小鼠並無明顯差別,但7天後出現體型及胰臟較小的現象。且胰臟外分泌組織的腺泡細胞(acinar cell)較正常小鼠小、細胞質顆粒也較少,顯示外分泌組織產生變化。
接著分析胰臟外分泌組織發育障礙對內分泌組織機能所產生的影響。結果發現空腹的Pdx1基因剔除小鼠出現輕度的高血糖症狀;在出生後28天的腹腔內葡萄糖負荷試驗,血糖值未正常下降;在葡萄糖注射後15分鐘的血漿,負責調降血糖的胰島素濃度低,顯現血糖恆定維持機制受阻,具糖尿病症狀。
最後,為解析Pdx1基因剔除小鼠出現糖尿病原因,觀察其胚胎期胰臟形成過程,發現外觀雖與控制組無顯著差異,但從14.5天開始,原本正常情況下發育為內分泌組織的胰管分支細胞發生細胞凋亡(apoptosis),造成內分泌細胞比率低,無法正常地進行內分泌組織的分化。以上結果證實在胰臟發育過程,內分泌細胞的分化受到外分泌細胞所分泌某種物質的影響。
若比較出生後小鼠,Pdx1基因剔除小鼠的內分泌組織-胰島較小;在出生後1天,也未觀察到分泌胰島素的成熟β細胞;出生後細胞增殖活性低。Pdx1基因剔除小鼠出生後28天,成熟指標雖與控制組一樣達到相同程度,但是,α細胞卻出現於胰島內部,正常小鼠的α細胞乃是排列在胰島外圍產生升糖素(glucagon),顯示Pdx1基因剔除小鼠的胰島構造出現異常。
該研究團隊認為,藉由多能性幹細胞開發糖尿病治療法時,宜同時製作內分泌及外分泌組織的胰臟,以避免內分泌細胞的分化或成熟受到阻礙。該研究成果於2016年2月刊載科學期刊「Scientific Reports」。
名詞解釋
- 胰島 : pancreatic island; islets of Langerhans;分泌糖類代謝相關激素至血液,負責血糖濃度調節的組織。由α細胞、β細胞、δ細胞、PP細胞所組成。
- 升糖素 : glucagon,自胰島α細胞分泌至血液的激素,提高血糖濃度。與胰島素作用相拮抗。
延伸閱讀
- 昇糖素與胰島素(Glucagon and Insulin)
highscope.ch.ntu.edu.tw/wordpress/?p=1049 - 糖尿病治療的爭議
highscope.ch.ntu.edu.tw/wordpress/?p=38221


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
