緩衝溶液的原理與配製
緩衝溶液(Buffered Solution)的原理與配製
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
以弱酸HA與其共軛鹼A-來配製溶液時,根據弱酸HA解離反應
HA⇌H++A–
又pH=-log[H+]、pKa=-logKa
此一方程式稱做韓德森方程式(Henderson-Hasselbalch Equation)。
當 [HA] = [A–] 時,pH = pKa。
緩衝溶液的pH值,根據韓德森方程式計算可由弱酸的Ka和其弱酸與弱酸鹽的比例來決定。在溶液當中,弱酸濃度不低的狀況下,酸的的解離量相當有限,[HA]可視為常數。
[A–] = [A-]0 + x (解離量) ≈ [A–]0
[HA] = [HA]0 + x (解離量) ≈ [HA]0
例如,一個0.0500 M醋酸與0.100 M醋酸鈉混合的緩衝溶液(醋酸pKa = 4.74),其pH=5.04。(算式如下)
但是當溶液較為稀薄時,即必須考慮弱酸解離造成的[HA]的影響,便無法使用此一近似。
除此之外,我們還可以透過其他的方式來配製一個緩衝溶液。我們可以考慮一個弱酸與強鹼(OH–)的混合:
HA+OH– ⇌ H2O+A–
一個弱酸與強鹼的中和產生弱鹼陰離子A–,得到緩衝溶液中所需要的共軛酸鹼對HA與A– 。例如 前述由0.05 M醋酸與0.1 M醋酸鈉組成的緩衝溶液,可改由0.1 M的氫氧化鈉加入0.15 M的醋酸溶液中和而得, 溶液中0.1 M的醋酸和氫氧化鈉反應成醋酸根離子,相當於加了0.1M的醋酸鈉 。
利用調整共軛酸鹼比例的方式,我們可以配製想要的特定pH值的緩衝溶液。例如如何用碳酸鈉和碳酸氫鈉配製pH = 9.50的緩衝溶液。
H2 CO3 ⇌ H++HCO3– pKa = 10.25
根據韓德森方程式
所以將0.18 mol碳酸鈉配上1.0 mol碳酸氫鈉溶於水中即可得到pH = 9.50的緩衝溶液。
配製好的緩衝溶液加入酸鹼後,溶液的pH值也可由韓德森方程式求得。例如0.050 M醋酸/0.100 M醋酸鈉混合的緩衝溶液,其溶液起始pH=5.04。
在1 L的0.050 M醋酸/0.100 M醋酸鈉緩衝溶液中加入1.000 N NaOH 1.000 mL,
CH3COOH : 0.050 M * 1 L – 1.000 N * 1.000 mL = 0.049 mol
CH3COO– : 0.100 M * 1 L + 1.000 N * 1.000 mL = 0.101 mol
故加入鹼後,緩衝溶液的pH幾乎沒有改變。
因為加入的鹼量很少,一般計算上可以忽略醋酸和醋酸鈉的改變量,即
CH3COOH : 0.050 M * 1 L – 1.000 N * 1.000 mL = 0.049 mol ≈ 0.05 mol
CH3COO– : 0.100 M * 1 L + 1.000 N * 1.000 mL = 0.101 mol ≈ 0.10 mol
若加入更多的鹼,1.000 N NaOH 10.00 mL,
CH3COOH : 0.050 M * 1 L – 1.000 N * 10.00 mL = 0.04 mol
CH3COO– : 0.100 M * 1 L + 1.000 N * 10.00 mL = 0.11 mol
溶液pH稍稍上升至5.18。
反之,若加入酸,1.000 N HCl 1.000 mL,
CH3COOH : 0.050 M * 1 L + 1.000 N * 1.000 mL = 0.051 mol
CH3COO– : 0.100 M * 1 L – 1.000 N * 1.000 mL = 0.099 mol
緩衝溶液的pH幾乎沒有改變 ,顯現良好的緩衝效果。
參考資料
1. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; p. 279-293.


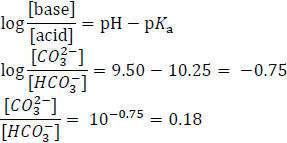




 前一篇文章
前一篇文章 下一篇文章
下一篇文章
