絕熱過程(Adiabatic process)
絕熱過程(Adiabatic process)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
絕熱過程是在熱力學(thermodynamics)當中常見的一個變化過程,指沒有任何能量以熱的形式進出系統(A process in which no energy as heat flows into or out of the system)。絕熱過程中系統不會與外界交換熱量、粒子,具有熱力學上重要的特性,經常被在熱力學當中被討論。
以熱力學方程式來解釋絕熱系統。在熱力學中,第一熱力學定律(The first law of thermodynamics)告訴我們:能量守恆;故系統內的能量為系統內所有粒子的位能與動能的總和。系統的內能(Internal energy, U)會因為熱(Heat, q)與功(Work, w)改變,所以內能的變化就可以表示為:
ΔU = q + w
而在絕熱過程當中,其系統內外的熱量交流為0,即熱量變化q = 0,可將式子改寫得到:
ΔU = w
即系統內能的變化是由於外界對其做功,或是其對外界做功所造成。
值得注意的是,絕熱過程經常與等溫過程(Isothermal process)混淆,等溫過程為「過程中無溫度變化」,即ΔT = 0。又 ΔU = Cv ΔT,透過溫度的無變化,得到的是內能的變化為0,故推得等溫過程中q = –w。由此可看到兩者的意義是不相同的。對於一個封閉系統施加壓力(例如嘴巴貼著手臂吹氣或吸氣),可以清楚感受到溫度的改變,亦即絕熱過程雖然完全阻隔了熱量的傳遞,但其並無法令系統內的溫度維持一定。
絕熱過程一般而言可以由其進行的方向,分為絕熱膨脹與絕熱收縮兩大類;絕熱膨脹即系統內對外界做功,其w為負值,因此內能變化亦為負值,溫度下降。而反之絕熱收縮則為外界對系統作功,其w為正值,因此內能變化亦為正值,溫度上升。
在可逆的絕熱過程當中,根據熵的定義 ΔS = qrev / T,可以發現其熵改變為零。
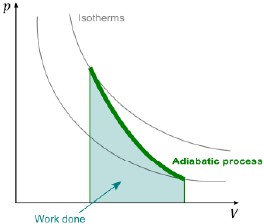
絕熱過程的一個特徵是,隨著系統體積的變化,其壓力的改變較等溫過程為劇烈。(見圖一)
利用內能與功之間的關係,推導出其溫度與體積必定遵守下列關係式:
![]() 此關係式亦可利用理想氣體方程式PV = nRT代入,置換成壓力與體積的關係:
此關係式亦可利用理想氣體方程式PV = nRT代入,置換成壓力與體積的關係:
其中令(nR / CV ) + 1 = γ。由此可以得到,在絕熱過程當中,壓力與體積的冪次方乘積PVγ為一定值。而透過理想氣體方程式PV = nRT,在等溫過程中T為定值,因而PV亦為定值。而又γ > 1,因此可發現在絕熱過程中系統體積定量改變時,其壓力的隨之改變,是相較於等溫過程來得大的。
參考資料:
1. Silbey, R. J.; Alberty R. A.; Bawendi M. G. Physical Chemistry, 4th edition; John Wiley and Sons, Inc.: Hoboken, 2004; pp. 33, 54-56.
2. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; pp. 446-450.
3. Wikipedia—Adiabatic process http://en.wikipedia.org/wiki/Adiabatic_process


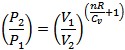
 前一篇文章
前一篇文章 下一篇文章
下一篇文章
