磷酸(Phosphoric acid)
磷酸(Phosphoric acid)
國立臺灣師範大學化學系碩士班一年級曹育碩
磷酸或正磷酸,分子式 $$\bf{H_3PO_4}$$,外觀為白色固體或無色黏稠液體,是一種常見的無機酸,亦為中強酸。而磷酸具有酸的通性,酸性較硫酸(sulfuric acid)、鹽酸(hydrochloric acid)、硝酸(nitric acid)弱,但酸性比醋酸(acetic acid)、硼酸(boric acid)強,可溶於水和乙醇。
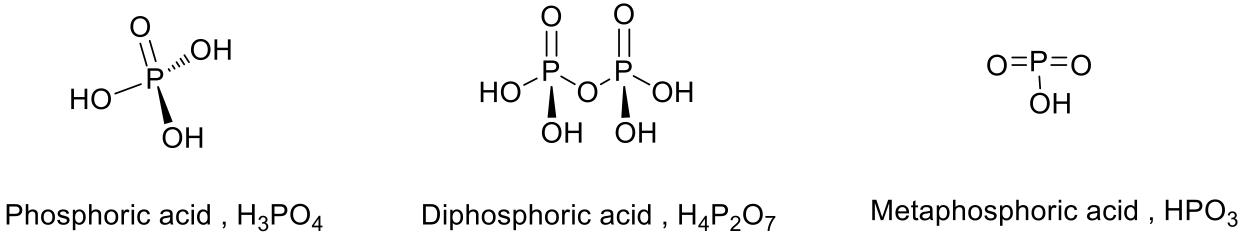
磷酸在空氣中容易潮解,加熱至 $$213^\circ C$$ 會慢慢失去部分水分子生成焦磷酸(diphosphoric acid,$$\bf{H_4P_2O_7}$$,無色黏稠液體,靜置可生成玻璃狀結晶,在工業上常用作催化劑,製造有機磷酸酯等),進一步加熱至 $$300^\circ C$$ 則會失去一分子水而生成偏磷酸(metaphosphoric acid,$$\bf{HPO_3}$$,無色玻璃狀固體,容易潮解,易溶於水生成正磷酸)。
純磷酸具有低熔點、無色、可結晶固體 $$m.p.~42^\circ C$$,在實驗室中容易製備糖漿狀磷酸溶液達 $$82\%$$,此方式亦做為工業上重要方法之一。磷酸的原料主要是磷礦和無機酸(硫酸、鹽酸或硝酸,主要為硫酸),天然磷礦主要成分都是氟磷酸鈣,磷礦的含量和有害雜質的種類及含量,對濕法生產磷酸的經濟影響很大,開採的磷礦一般需經過集體處理,提高其百分比和排除雜質,才能滿足濕法(wet process )磷酸生產的要求。
工業上常用濕法製造磷酸,利用濃硫酸和磷酸鈣反應生成磷酸,過濾微溶於水的硫酸鈣沉澱物,所得到的濾液就是磷酸溶液。也可利用加熱法燃燒元素磷產生五氧化二磷並溶解於水中即可生成磷酸水溶液。
磷酸亦為肥皂、洗滌劑、金屬表面處理劑、食品添加劑、飼料添加劑和水處理劑的所用的各種磷酸鹽、磷酸酯的原料。磷酸主要用於磷酸鹽工業如磷酸銨、磷酸二氫鉀、磷酸氫二鈉、磷酸三鈉,精製磷酸含磷酸氫鈣用於製造飼料。
醫藥工業使用磷酸製造甘油磷酸鈉、磷酸鐵等,也用於製造磷酸鋅作為牙科補牙。印刷工業使用磷酸配置清洗劑除去膠印彩印版上的污點。冶金工業利用磷酸生產耐火水泥,增加煉鋼爐的壽命。塗料工業利用磷酸製造金屬防鏽漆。而食品工業中磷酸可作為酸味劑、酵母營養劑等,如可樂中便含有少量磷酸。磷酸亦是化肥工業生產中重要的中間產品,可生產高濃度磷肥和複合肥料。
磷酸為三質子酸,可分成三步解離,不容易揮發,亦不容易分解,且幾乎沒有氧化性。磷酸有吸濕性,能吸收空氣中水分,對皮膚有腐蝕性,空氣中最高容許濃度為 $$1~mg/m^3$$。磷酸蒸氣對眼、鼻、喉有刺激性。誤食液體會導致噁心、嘔吐、腹痛、血便或休克。皮膚或眼直接接觸會造成灼燒傷。慢性影響:鼻黏膜萎縮、鼻中隔穿孔。長期與皮膚接觸,會引發皮膚刺激過敏。磷酸本身不易燃,但可與金屬反應生成氫氣,能與空氣形成爆炸性混合物,受熱時分解生成劇毒的氧化磷煙氣,具有強腐蝕性。
參考資料
- 磷酸 http://en.wikipedia.org/wiki/Phosphoric_acid
- McMURRY , FAY , ( 4th edition ) , Chapter 19 , 841-842.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
