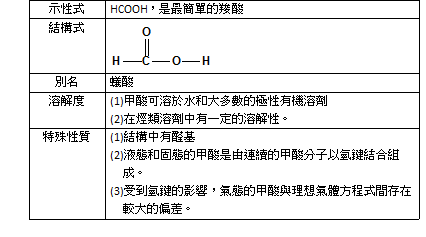
甲酸
甲酸 (Formic Acid)
臺北市立第一女子高級中學二年級許景皓/臺北市立第一女子高級中學化學科詹莉芬老師修改/國立臺灣師範大學化學系葉名倉教授責任編輯
一、甲酸的基本資料
二、甲酸的製備
甲醇和一氧化碳在強鹼條件下反應生成甲酸甲酯,在經水解反應可得到甲酸:
CH3OH+CO→HCOOCH3
HCOOCH3+H2O→HCOOH+CH3OH
為避免需要大量的水,有些化學廠在甲醇和一氧化碳生成甲酸甲酯後,先將甲酸甲酯和氨反應產生甲醯胺,然後用硫酸水解甲醯胺得到甲酸:
CH3OH+CO→HCOOCH3
HCOOCH3+NH3→HCONH2+CH3OH
2HCONH2+2H2O+H2SO4→2HCOOH+(NH4)2SO4
此反應亦有其缺點:副產物硫酸銨的處理較繁複。
․也有些化學廠在最近發展了一類節能的方法,即將甲酸從直接水解的大量水溶液中提取出來。
三、甲酸的相關化學反應
(1) 甲酸具有羧基,有酸的性質:
․屬於弱酸,Ka=1.8×10-4,酸性比乙酸強。
․甲酸與活性大的金屬反應(氧化還原反應)產生氫氣,由於甲酸屬於弱酸,因此反應速率較為緩慢。
․甲酸與鹼性物質進行酸鹼中和反應。
․甲酸與碳酸根或碳酸氫根水溶液反應產生CO2
(2)由於甲酸具有醛基,甲酸的還原性,可與多侖試劑產生銀鏡反應,或與斐林試劑產生紅色Cu2O沈澱。
HCOOH+2Ag(NH3)2++4OH-→CO32-+2Ag+4NH3 +3H2O
HCOOH+2Cu2++6OH-→CO32-+Cu2O+4H2O
(3)分解作用
․甲酸和濃硫酸或氧化鋁共熱會使甲酸脫水產生一氧化碳,這是常見的實驗室一氧化碳來源。
HCOOH  CO+H2O
CO+H2O
․甲酸在白金催化下不需要高壓就可分解成氫氣和二氧化碳
HCOOH  CO2+H2
CO2+H2
因此甲酸也被視為一種儲存氫氣的方法。
․甲酸在氧化鋅或高錳酸鉀催化下可分解成氫氣和二氧化碳
HCOOH  CO2+H2
CO2+H2
․甲酸與胺在金屬釕的催化下,甲酸可分解成氫氣和二氧化碳。
[補充說明]燃料电池當務之急要解決的是氫氣的來源,使用含有氫的原料,在需要分解產生氫氣要比直接傳送氫氣更實用。目前德國材料研究團隊事利用上述反應物僅於在26℃—40℃就可以將甲酸分解產生氫氣。甲酸是一種液体,比氣體更容易處理理。且添加胺類的混合物可降低甲酸的腐蝕性。目前已可應用於甲酸燃料電池,且體積比甲醇燃料電池還精巧。(4)加成反應
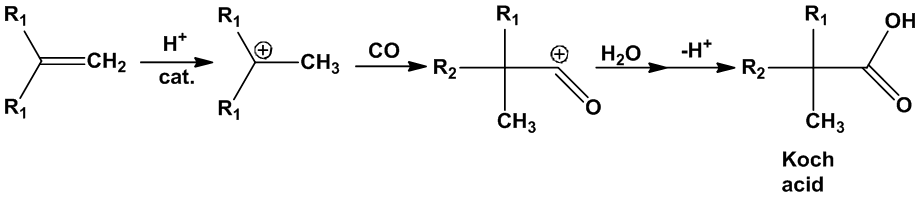
甲酸是唯一能進行加成反應的羧酸:甲酸和烯烴會反應產生甲酸酯。但在反應過程中若是添加了硫酸或氫氟酸等特定酸類,則會發生一連串的Koch反應(Koch reaction)產生更高級的羧酸。
[補充說明] Koch reaction
參考資料
1.http://en.wikipedia.org/wiki/Formic_acid
2.http://zh.wikipedia.org/zh-tw/甲酸
3.http://www.chemguide.co.uk/organicprops/acids/acidity.html#top
4.http://www.most.gov.cn/gnwkjdt/200806/t20080604_62182.htm
5.http://zh.wikipedia.org/zh-tw/Koch%E5%8F%8D%E5%BA%94



 前一篇文章
前一篇文章 下一篇文章
下一篇文章
