環氧乙烷(Ethylene oxide)(V)
環氧乙烷(Ethylene oxide)(V)
台北市立永春高級中學化學科蔡曉信老師 / 國立臺灣師範大學化學系葉名倉教授責任編輯
熱分解(Thermal decomposition)
環氧乙烷在無催化劑的情況下是相當安定的,加熱的溫度不超過300℃時不會分解,溫度高於570℃時主要是進行自由基反應機構的放熱分解反應。分解的第一階段為異構化,然而高溫使自由基的流程加快。產生許多混合的氣體產物如:乙醛、乙烷、乙基、甲烷、氫、二氧化碳、乙烯酮(ketene)和甲醛等。在惰性氣體下進行高壓高溫(830~1200℃)熱裂解會產生更複雜的產物,但仍含有乙炔及丙烷。與異構化不同其起始的反應如下:
(CH2CH2)O → •CH2CH2O• → CH2O + CH2:2CH2)O + (NH2)2C=S → (CH2CH2)S + (NH2)2C=O
當環氧乙烷的熱分解反應在有過渡金屬的催化條件下,不僅反應溫度可以降低也可得到以乙基為主的產物。
其他反應
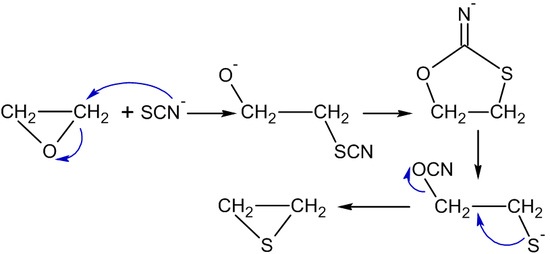
硫氰離子(Thiocyanate)或硫脲(thiourea)可將環氧乙烷轉變成環硫乙烯(thiiranes)(ethylene sulfides):
(CH
環氧乙烷與五氯化磷反應生成二氯乙烷:
(CH2CH2)O + PCl5 → Cl–CH2CH2–Cl + POCl3
其他環氧乙烷的二氯衍生物可用硫醯氯(sulfuryl chloride)-吡啶與三苯基膦(triphenylphosphine)-四氯化碳等試劑而製得。
環氧乙烷與三氯化磷反應生成氯乙基亞磷酸酯(chloroethyl esters of phosphorous acid)
(CH2CH2)O + PCl3 → Cl–CH2CH2–OPCl2
2 (CH2CH2)O + PCl3 → (Cl–CH2CH2–O)2PCl
3 (CH2CH2)O + PCl3 → Cl–CH2CH2–O)3P
環氧乙烷與乙醯氯及碘化鈉反應生成碘乙基醚:
(CH2CH2)O + RCOCl + NaI → RC(O)–OCH2CH2–I + NaCl
加熱至100℃使環氧乙烷與二氧化碳及三苯基膦-鎳(0)的非極性溶液反應則產生碳酸乙二醇(ethylene carbonate):
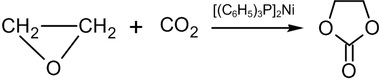 在工業上有一種相似的反應,其反應條件為在高溫高壓下以四級銨鹽或磷鹽當催化劑。
在工業上有一種相似的反應,其反應條件為在高溫高壓下以四級銨鹽或磷鹽當催化劑。
甲醛在80~150℃下與環氧乙烷作用產生1,3-二氧戊烷(1,3-dioxolane):
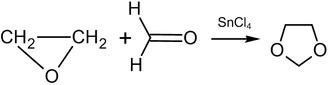 若用其他種類的醛與酮來取代甲醛則產生二取代的1,3-二氧戊烷(產率:70~85%)。
若用其他種類的醛與酮來取代甲醛則產生二取代的1,3-二氧戊烷(產率:70~85%)。
環氧乙烷加氫醛化(hydroformylation)可得羥基丙醛或進一步得到1,3-丙二醇(propane-1,3-diol):2CH2–OH + NaOH → (CH2CH2)O + NaCl + H2O
實驗室製備法(Laboratory synthesis)
乙烯與其衍生物脫氯化氫
以2-氯乙醇脫氯化氫是1859年由爾茨所提出,到目前為止仍是實驗室中最普遍製造環氧乙烷的方式。
Cl–CH
這個製備方式除了可用氫氧化鈉之外亦可用氫氧化鉀、氫氧化鈣、氫氧化鋇、氫氧化鎂或鹼金與鹼土族的碳酸鹽類。
而氯乙醇可用下列方法製得:
- 乙二醇與氯化氫反應
HO–CH2CH2–OH + HCl → HO–CH2CH2–Cl + H2O - 乙烯與次氯酸反應
CH2=CH2 + HOCl → HO–CH2CH2–Cl - 乙烯氯化
CH2=CH2 + Cl2 + H2O → HO–CH2CH2–Cl + HCl
另外有一個方便而古老的方法是用氯乙基乙酸酯與鹼反應:
Cl–CH2CH2–OCOCH3 + 2 KOH → (CH2CH2)O + KCl + CH3COOK + H2O3CH2–OCl + CaO → 2 (CH2CH2)O + CaCl2 + H2O2 + NaOH + CH3CH2OH → CH3CH2OCl + NaCl + H2O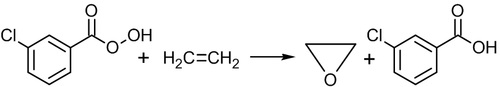 但此方法的反應速率慢與產率低,因此無法在工業上使用。
但此方法的反應速率慢與產率低,因此無法在工業上使用。
若用氧化鈣與次氯酸甲酯(ethyl hypochlorite)反應其產率可高達90%,但若改用其他種類的鹼土金屬來代替會降低其產率。
2 CH
而次氯酸甲酯可用下列方式製得:
Cl
直接以過氧酸氧化乙烯(Direct oxidation of ethylene by peroxy acids)
以過氧苯甲酸或間-氯過氧苯甲酸可直接將乙烯氧化成環氧乙烷。
其他製備方式
用二碘乙烷與氧化銀作用
I-CH2CH2–I + Ag2O → (CH2CH2)O + 2 AgI
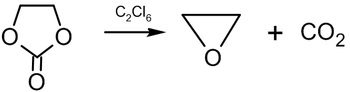
或將碳酸乙二醇在200~210℃下與六氯乙烷作用
參考資料:
1.Ethylene_oxide。檢索日期 2011.6.5,http://en.wikipedia.org/wiki/Ethylene_oxide
2.楊思廉(1991),工業化學概論,五洲出版社,p.264~266。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
