環氧乙烷(Ethylene oxide)(IV)
環氧乙烷(Ethylene oxide)(IV)
台北市立永春高級中學化學科蔡曉信老師 / 國立臺灣師範大學化學系葉名倉教授責任編輯
亞硝酸與硝酸的加成反應(Addition of nitrous and nitric acids)
亞硝酸鋇、亞硝酸鈣、亞硝酸鎂、亞硝酸鋅與亞硝酸鈉等物質的水溶液可與環氧乙烷作用形成2-硝基乙醇(2-nitroethanol):
2 (CH2CH2)O + Ca(NO2)2 + 2 H2O → 2 HO–CH2CH2–NO2 + Ca(OH)2而硝酸與環氧乙烷反應則產生單與雙硝基乙二醇(mono- and dinitroglycols):
芳香烴化合物的加成反應(Additions with aromatic compounds)
苯與與環氧乙烷反應會進行”夫里德耳-夸夫特”反應(Friedel-Crafts reaction)產生苯乙醇:
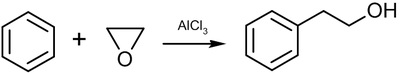
假如將反應的溫度調高到315~440℃,壓力為0.35~0.7MPa下,以矽酸鋁為催化劑則產生苯乙烯(Styrene)。
合成冠狀醚類(Synthesis of crown ethers)
環氧乙烷也可用來合成一系列的雜環化合物如:冠狀醚,其中一種方式是環氧乙烷自身行陽離子環化聚合反應,並控制其環形成的大小,同時我們用高度稀釋的溶液來控制其他線形聚合物的形成。環氧乙烷與二氧化硫及銫鹽作用可形成十一環的化合物,它是一種有複雜性質的冠狀醚。
異構化反應(Isomerization)
當環氧乙烷加熱到400℃或溫度150~300℃在有三氧化鋁、磷酸等催化劑的催化下,它可轉化成乙醚。
![]()
西尼-本生(Sidney W. Benson)提出其自由基反應機構,其反應步驟如下:
1) (CH2CH2)O ↔ •CH2CH2O• → CH3CHO*
2) CH3CHO* → CH3• + CHO•
3) CH3CHO* + M → CH3CHO + M*
還原反應
環氧乙烷在鎳、鉑、鈀、硼烷、氫化鋰鋁或其它氫化物的催化下可轉變成乙醇。
![]() 相反的若加入某些其它的催化劑(如鋅粉、乙酸、氫化鋰鋁、三氯化鈦)則能將環氧乙烷還原成乙烯其產率約有70%。
相反的若加入某些其它的催化劑(如鋅粉、乙酸、氫化鋰鋁、三氯化鈦)則能將環氧乙烷還原成乙烯其產率約有70%。
氧化反應
環氧乙烷在不同的條件下能氧化成乙醇酸(glycolic acid)或二氧化碳
![]()
在氣相反應器中,施以800~1000K及0.1~1Mpa的反應條件下,會產生複雜的混合產物,有氧氣、氫氣、一氧化碳、二氧化碳、甲烷、乙烯、乙炔、乙烷、丙烯、丙烷和乙醛等。
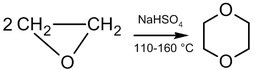
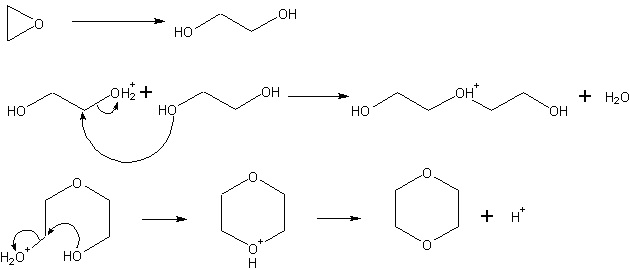
二聚合反應
在酸催化下,環氧乙烷能行二聚合反應形成二 烷(1,4-二氧陸圜)(dioxane)。
此二聚合反應是無選擇性的,因此必定會有副產物如乙醛(因異構化之故)的產生。但我們發現此二聚合反應的選擇性及反應速率與所加入催化劑的量成正相關,如加入鉑、鉑-鈀合金或碘環丁碸(iodine with sulfolan)時,但後者會產生2-甲基-1,3-二氧戊環(2-methyl-1,3-dioxolane)的副產物。
聚合反應
液態的環氧乙烷會形成聚乙二醇,其聚合方式可經由自由基與離子兩種反應機構,但只有後者有廣泛的實際應用。陽離子聚合是環氧乙烷用含質子酸(過氯酸、氫氯酸)、路易士酸(氯化錫、三氟化硼等)、有機金屬化合物或更複雜的試劑反應。
![]() 反應機構如下:第一步驟MXm為催化劑先使反應物產生活性氫原子(active hydrogen atoms)
反應機構如下:第一步驟MXm為催化劑先使反應物產生活性氫原子(active hydrogen atoms)
MXm + ROH → MXmRO–H+
活性氫原子與環氧乙烷進行SN2的反應
(CH2CH2)O + MXmRO–H+ → (CH2CH2)O•••H+O–RMXm
(CH2CH2)O•••H+ O–RMXm → HO–CH2CH2+ + MXmRO–2
HO–CH2CH2+ + n (CH2CH2)O → HO–CH2CH2–(O–CH2CH2)n+
HO–CH2CH2–(O–CH2CH2)n+ + MXmRO– → HO–CH2CH2–(O–CH2CH2)n–OR + MXm
H(O–CH2CH2)n–O–CH2–CH2+ + MXmRO– → H(O–CH2CH2)n–O–CH=CH2 + MXm + ROH
陰離子聚合是在鹼性條件下進行,其反應機構如下:
(CH2CH2)O + RONa → RO–CH2CH2–O–Na+
RO–CH2CH2–O–Na+ + n (CH2CH2)O → RO–(CH2CH2–O)n–CH2CH2–O–Na+
RO–(CH2CH2–O)n–CH2CH2–O–Na+ → RO–(CH2CH2–O)n–CH=CH2 + NaOH
RO–(CH2CH2–O)n–CH2CH2–O–Na+ + H2O → RO–(CH2CH2–O)(n+1)OH + NaOH
參考資料:
1.Ethylene_oxide。檢索日期 2011.6.5,http://en.wikipedia.org/wiki/Ethylene_oxide
2.楊思廉(1991),工業化學概論,五洲出版社,p.264~266。



 前一篇文章
前一篇文章 下一篇文章
下一篇文章
