環氧乙烷(Ethylene oxide)(II)
環氧乙烷(Ethylene oxide)(II)
台北市立永春高級中學一年級錢立珩/台北市立永春高級中學化學科蔡曉信老師 / 國立臺灣師範大學化學系葉名倉教授責任編輯
分子結構與性質(Molecular structure and properties)
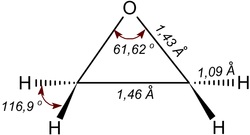
環氧乙烷的形狀幾乎為正三角形,鍵角大約為60°,與醇類及醚類相比,醇類的C–O–H鍵角為110°而醚類C–O–C 鍵角為 120°,環氧乙烷的60°鍵角顯然小很多,因此有明顯的鍵角張力其能量為105 kJ/mol(如下圖)。
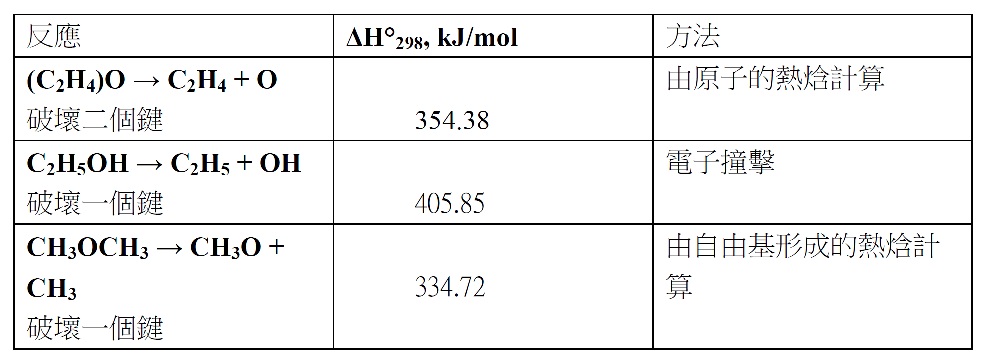
分子主軸的轉動慣量:IA = 32.921×10−40 g•cm2, IB = 37.926×10−40 g•cm2; 及 IC = 59.510×10−40 g•cm2;.在17~176℃的溫度範圍時其偶極矩為6.26×10−30 C•m。我們可由比較破壞環氧乙烷二個C–O鍵及醇與醚中一個C–O鍵所需的能量大小來判斷C–O鍵在分子中的穩定度。其實驗結果如下表所示:
這個不穩定性決定它的化學活性,也解釋它在進行加成反應時開環是如此容易。
物理性質
環氧乙烷在25℃時為無色氣體,0℃時為流動的液體其黏度為水的5.5倍。它具有一般醚類微甜氣味的特性,尤其當其在空氣中的濃度超過500ppm時特別顯著。
它易溶於水、乙醇、二乙醚及許多種有機溶劑中。其主要熱力學常數如下:
- 標準莫耳熱容量:Cp° = 48.19 J/(mol•K)
- 標準生成熱:ΔH°298 = –51.037 kJ/mol
- 標準熵:S°298 = 243.4 J/(mol•K)
- 吉布斯自由能:ΔG°298 = –11.68 kJ/mol
- 燃燒熱:ΔHc° = –1306 kJ/mol
而液態環氧乙烷的表面張力在–50.1 °C 時為35.8 mJ/m2,在–0.1 °C時為27.6 mJ/m2 。
化學性質
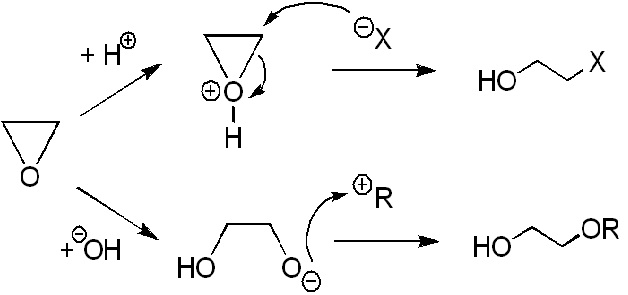
環氧乙烷分子內的C–O鍵很容易斷裂開環而與各種不同的化學物質反應。典型的反應為環氧乙烷分子與親核試劑(nucleophiles)在酸性(弱親核試劑:水與醇類)或鹼性(強親核試劑:OH–, RO–, NH3, RNH2, RR’NH等)條件下進行SN2取代反應。其反應的簡單流程如下:
加水或加醇反應(Addition of water and alcohols)
環氧乙烷的水溶液是相當安定,可長時間存在無顯著的化學反應,但若加入少量的酸如稀硫酸時,即使在常溫下也會立刻生成乙二醇:
(CH2CH2)O + H2O → HO–CH2CH2–OH
此反應在氣相中以磷酸鹽當催化劑時也能進行。上述反應通常在約60℃下與大量的水作用,如此可避免產生的乙二醇再與環氧乙烷反應產生二聚或三聚合的二醇類。
2 (CH2CH2)O + H2O → HO–CH2CH2–O–CH2CH2–OH
3 (CH2CH2)O + H2O → HO–CH2CH2–O–CH2CH2–O–CH2CH2–OH
若以鹼當催化劑能產生多聚合二醇類。
n (CH2CH2)O + H2O → HO–(–CH2CH2–O–)n–H
與醇作用產生乙二醇醚。
(CH2CH2)O + C2H5OH → HO–CH2CH2–OC2H5 2 (CH2CH2)O + C2H5OH → HO–CH2CH2–O–CH2CH2–OC2H5
環氧乙烷與脂肪醇作用在金屬鈉、氫氧化鈉或三氟化硼的反應條件下可合成界面活性劑。
參考資料:
1.Ethylene_oxide。檢索日期 2011.6.5,http://en.wikipedia.org/wiki/Ethylene_oxide
2.楊思廉(1991),工業化學概論,五洲出版社,p.264~266。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
