熱平衡 〈Thermodynamic Equilibrium〉
熱平衡(Thermodynamic Equilibrium)
國立彰化高級中學賴文哲教師/國立彰化師範大學物理系洪連輝教授責任編輯
一個系統達到熱平衡(Thermodynamic equilibrium)即表示,其壓力、溫度、體積等巨觀的物理性質都不會隨時間而改變,但粒子與粒子之間仍存在能量交換。舉例來說,一個理想的氣體系統達熱平衡,其溫度即維持恆定,但粒子速率分佈函數遵守馬克士威分子速率分佈,並非每一個粒子速率都相同。而兩個互相處於平衡狀態的系統,兩者各自處於平衡狀態且兩者在可以交換熱量的情況下,仍然保持平衡狀態。
因此,熱平衡是熱力學系統之間一種重要的關係。有關熱平衡的定律雖然提出較晚,但如第一﹑第二定律一樣也是熱力學中重要的基本實驗定律﹐且更為基本,所以稱它為熱力學第零定律(Zeroth law of thermodynamics)。熱力學第零定律其表述為:『若兩個熱力學系統均與第三個系統處於熱平衡狀態,此三個系統也必互相處於熱平衡』。
在熱力學相關變數的函數空間之中,固定溫度的部分會成為一個面(P-V圖),該恆溫面的維度是熱力學變量的總數減一(例如對於有三個熱力學變量 P、V、n 的理想氣體,其恆溫面是二維面)。以理想氣體為例,若兩團氣體是處於熱平衡,則:
•Pi 是第 i 個系統的壓力
•Vi 是第 i 個系統的體積
•Ni 是第 i 個系統的數量(莫爾數或者原子數目)
或表示為PV / N = RT,R 是一個常數而溫度T 可以由此定義。經定義後,這些系統可用作溫度的標準,用來校準其他系統。
參考資料:
1. Thermodynamic equilibrium. http://en.wikipedia.org/wiki/Thermodynamic_equilibrium
2. Zeroth law of thermodynamics. http://en.wikipedia.org/wiki/Zeroth_law_of_thermodynamics


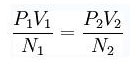
 前一篇文章
前一篇文章 下一篇文章
下一篇文章 維恩位移定律
維恩位移定律 
