緩衝溶液
緩衝溶液 (Buffer solutions)
臺北市立第一女子高級中學高中三年級蔡宛庭/臺北市立第一女子高級中學化學科詹莉芬老師修改/國立臺灣師範大學化學系葉名倉教授責任編輯
定義
緩衝溶液是指由弱酸及其共軛鹼(或弱鹼及其共軛酸)所組成的緩衝對配製的,能夠在加入少量的酸或鹼時,可以減緩pH改變的溶液。即一緩衝溶液pH值=5, 表示該溶液可控制溶液內的其他反應進行時,即使產生少量的強酸或強鹼或水而稀釋濃度,緩衝溶液都可維持溶液的pH值僅有小幅改變。
實驗
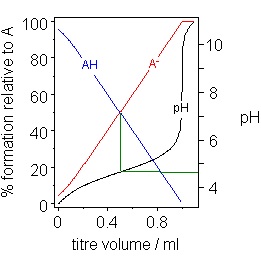
以強鹼溶液滴定弱酸溶液,加入強鹼的體積與酸鹼中和後溶液的pH值(可由pH meter測得)關係圖如下,經分析溶液中存在的HA、A-共軛酸鹼對可知,當溶液中存在[HA]、[A-]兩者濃度約略相等時,溶液的pH值變化量較為平緩,此混合溶液即相當於緩衝溶液。
緩衝溶液的pH值
緩衝溶液的pH可經由同離子效應及亨德森-哈塞爾巴爾赫方程來計算。以弱酸HA為例,HA的解離常數被定義為:
取對數後可得到:
式中HA指緩衝對組分中的弱酸,A¯指其共軛鹼。顯然由此式可知,當組分中酸性物質與鹼性物質濃度相等時,溶液的pH=pKa。所以一般配製緩衝溶液時常選取pKa與溶液要控制的pH值相近的弱酸,pH值為pKa 1的範圍,譬如醋酸的Ka約10-5,緩衝溶液中若[CH3COOH]=[CH3COO-],由(2)式可知該緩衝溶液pH值約為5。
製備方法
常見幾種配製緩衝的方法:
(一)弱酸或弱鹼的共軛酸鹼對以適當比例混合,譬如
▲等濃度的醋酸與醋酸納可配成酸性環境的緩衝溶液,pH=pKa=4.73。
▲等濃度的氨水與氯化銨可配成鹼性的緩衝溶液,pH=9.27,pOH=pKb=4.73。。
(二)弱鹼加限量強酸,譬如:氨水與限量的鹽酸混合,經酸鹼中和後,溶液中存在氨水及銨根離子之共軛酸鹼對
(三)弱酸加限量強鹼,譬如:醋酸加限量氫氧化鈉,經酸鹼中和後,溶液中存在醋酸及醋酸根離子之共軛酸鹼對。
原理(一)
緩衝溶液能減緩pH改變是因為其中所含有的緩衝物質所形成的緩衝對(共軛酸鹼對,以HA、A-表示),存在平衡式:
HA(aq) →H+(aq) + A-(aq)
▲當溶液中加入少量酸性物質時,根據勒沙特列原理,少量酸可與緩衝對中的鹼性分子(A-)進行酸鹼中和,使平衡向左,多加入的酸性物質反應消耗。
▲當溶液中加入少量鹼性物質時,根據勒沙特列原理,少量鹼可與緩衝對中的酸性分子(HA)進行酸鹼中和,使平衡向右,使多加入的鹼性物質反應消耗。
原理(二)
以醋酸為例,已知醋酸的Ka=1.8 ×10-5,1公升的緩衝溶液中[CH3COOH]=[CH3COO-]=0.5 M,則根據(2)式可得溶液pH=4.74。
▲若加入0.01莫耳的NaOH,與CH3COOH反應後,緩衝溶液中存在[CH3COOH]=0.49 M,[CH3COO-]=0.51 M,則根據(2)式可得溶液pH=4.76。
▲若加入0.01莫耳的HCl,與CH3COO-反應後,緩衝溶液中存在[CH3COOH]=0.51 M,[CH3COO-]=0.49 M,則根據(2)式可得溶液pH=4.73。
由兩例都可知,同離子效應的計算,共軛酸鹼對的存在可形成緩衝溶液。
應用
▲在許多化學反應中,緩衝溶液被用於使溶液的pH值保持恆定。緩衝溶液對生命的產生與進化具有重要意義,因為多數生物都只能在一定pH範圍內生長,例如血液就是一種緩衝溶液。
▲緩衝溶液有許多用途,例如人體血液中含有磷酸二氫根-磷酸氫根、碳酸-碳酸氫鈉等多對緩衝對,維持血液的pH在7.35至7.45之間,以維持酶的活性。
在工業上,緩衝溶液常被用於調節染料的pH。緩衝溶液還可以被用於pH計的校正。
常見緩衝溶液系統
廣域緩衝溶液
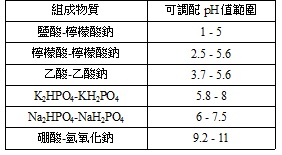
▲兩種以上的緩衝對配製而成的溶液可以獲得更大的pH調節範圍。配製緩衝溶液時常用磷酸,因為它是一種三級弱酸。McIlvaine緩衝溶液pH調節範圍為3-8,檸檬酸、磷酸氫鉀、硼酸與二乙基巴比妥酸的pH調節範圍為2.6-12。
▲除此之外常用的廣域緩衝溶液還有卡莫第緩衝溶液和布里頓-羅賓遜緩衝溶液。
參考資料
1. http://zh.wikipedia.org/wiki/%E7%BC%93%E5%86%B2%E6%BA%B6%E6%B6%B2
2. http://www.chemguide.co.uk/physical/acidbaseeqia/buffers.html
3. http://www.chem.ubc.ca/courseware/pH/section13/index.html
4. http://en.wikipedia.org/wiki/Buffer_solution


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
