活化錯合物(Activated Complex)
活化錯合物(Activated Complex)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
活化錯合物(Activated Complex) 用來描述一個化學反應裡,反應物轉變成產物過程中,原子重組的過渡狀態化合物,活化錯合物極不穩定,可以進一步分解成產物,也可能在能量不足的狀態下回復成生成物。
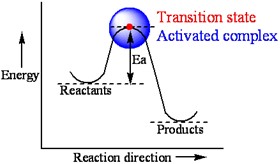
分子要進行化學反應,首先分子必須要有足夠發生反應的能量,發生反應的臨界能量稱為活化能(Activation energy, Ea),通常只有部份的分子的能量大於活化能可以進行反應。在過渡態理論(transition state theory),反應物分子碰撞達到活化能時形成「活化錯合物」。 此外,由於活化錯合物能量靠近活化能,顯示無論是吸熱反應還是放熱反應都需要吸收能量才能形成。活化錯合物的生存時間非常短,以10-12秒(picoseconds)計,從前活化錯合物是無法偵測的,但是現在科學家已經找到方法,利用10-15秒(femtosecond)的脈衝雷射(pulsed laser)光來觀察活化錯合物。透過研究活化錯合物,可以了解反應機制(Mechanism)和反應能量變化。
在許多普化課本中活化錯合物又稱過渡態(transition state),但是在進階的物理化學課本中,「活化錯合物」和「過渡態」其實具有不同的化學意義。我們常以化學反應位能圖(Reaction profile或reaction energy diagram)來描述一個化學反應 的能量改變。反應位能圖以化學反應的進行為橫坐標,反應位能為縱坐標,反應物和產物的位能高低依物質性質而定,反應物的能量不一定比產物低。反應物沿反應位能曲線變成產物,由於參與反應的反應物分子需要有足夠的能量進行原子重組,故反應位能上升,其最能量高點和反應物起始位能差為活化能(Ea)。剛好位於反應位能最高點的過渡化合物稱為「過渡態」。活化錯合物則是泛指「能量接近活化能的反應中間結構」。換句話說,過渡態是活化錯合物的一種。
參考資料:
1. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; p. 736.
2. Atkins, P. W.; De Paula, J. Atkins’ Physical Chemistry, 8th edition; Oxford University Press: New York, 2006, pp. 880-883.
3. Wikipedia—Activated complex http://en.wikipedia.org/wiki/Activated_complex
4. 陳竹亭主編,高級中學物質科學化學篇(上冊),第130頁至131頁,大考通訊社出版,2002年。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
