氧化還原滴定(Redox Titration)
氧化還原滴定(Redox Titration)
國立台灣大學化學系黃俊誠博士/國立台灣大學化學系陳藹然博士責任編輯
氧化還原滴定是以氧化還原反應為基礎,使用已知濃度的氧化劑或還原劑為標準溶液,以滴定法來分析未知物的濃度。酸鹼滴定時,根據酸能提供或鹼能接受氫離子的數目來決定中和時所需物質的量。相似的情形,氧化還原滴定時所使用氧化劑或還原劑的量與得失電子數有關,而且必須保持電量守恆。所以在氧化還原滴定時,可由已知濃度的氧化劑或還原劑之當量數,求得待測還原劑或氧化劑溶液濃度。 例如以過錳酸鉀溶液在酸性環境中滴定硫酸亞鐵溶液為例,身為氧化劑的錳(MnO4–)由+7價還原為+2價的亞錳離子(Mn2+),1莫耳的KMnO4須要得到5莫耳電子,但身為還原劑的亞鐵離子(Fe2+)被氧化成+3價的鐵離子(Fe3+),1莫耳的FeSO4僅釋出1莫耳的電子,因此1莫耳的KMnO4需5莫耳的FeSO4才能完全反應。(見下列的半反應式)
氧化半反應: 5Fe2+ → 5Fe3+ + 5e–
還原半反應: MnO4– + 5e– + 8H+→ Mn2+ + 4H2O
總反應: 5Fe2+ + MnO4– + 8H+→5Fe3+ + Mn2+ + 4H2O
此過錳酸根的氧化還原滴定常用來測定鐵礦砂中之鐵含量。 與酸鹼滴定相似,氧化還原滴定也需要指示劑或電位計來顯示滴定終點。有些氧化還原試劑反應前後顏色變化明顯,可以直接用來指示滴定終點,不必另加指示劑。如上述的過錳酸鉀滴定亞鐵的反應中,起始的被滴定液(硫酸亞鐵溶液)為淡綠色,滴定液(過錳酸鉀溶液)為紫色,在未到達當量點前,加入的紫色過錳酸鉀溶液會立即與硫酸亞鐵反應形成淡粉的亞錳離子,其紫色瞬間褪去;當滴定到接近當量點時,因為亞錳離子濃度低,反應變慢,所以溶液中的紫色褪得很慢;到當量點時,已無亞鐵離子可和過錳酸根反應,溶液呈現過錳酸根紫色,即為滴定終點,因此不必使用任何指示劑。 但是有的反應則須要另加指示劑,用以顯示滴定終點,如碘的氧化還原滴定中,常以澱粉當指示劑,因為碘分子(I2)和I–形成碘錯離子(I3–),此I3–會與澱粉結合呈現紫藍色。 維他命C中的抗壞血酸 (ascorbic acid)的定量,是常見碘的氧化還原滴定之應用,可藉由碘的氧化還原滴定來分析。抗壞血酸是還原劑,I2可以很快地被抗壞血酸還原成碘離子,被還原的碘分子則是由碘酸鉀溶液(KIO3)在酸性溶液中與碘化鉀(KI)反應提供。
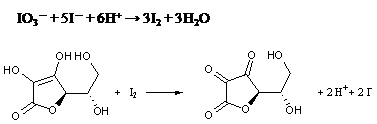
因為碘分子在溶液中定量不易,需加入澱粉當指示劑。碘酸根和碘離子反應生成的碘分子,會立即被溶液中的抗壞血酸還原成無色的碘離子,所以只有在溶液中抗壞血酸完全反應後,過量的I2才會與溶液中 I– 生成 I3–,並和預先加入的澱粉指示劑產生藍黑色錯合物而知達到滴定終點。 水中的溶氧量的測定,是另一個碘的氧化還原滴定之應用。將水樣加入硫酸亞錳溶液及鹼性碘化物後生成氫氧化亞錳,此時水中溶氧快速地將等價量且散佈於水中的氫氧化亞錳,氧化成更高價的錳氧化物而產生沈澱。當水樣加入濃硫酸,進一步變為酸性且有碘離子存在時,氧化的錳離子會回復為二價的狀態,同時釋放出與溶氧等價量的碘分子。此時可以用硫代硫酸鈉(Na2S2O3)標準溶液滴定碘分子,可求得溶氧量。 MnSO4 + 2NaI + 2OH–→Mn(OH)2+ Na2SO4 + 2I– 2Mn(OH)2 + O2→2MnO2 + 2H2O MnO2 + 2I– + 4H+→Mn2+ + I2 + 2H2O 2S2O32- + I2→S4O62- + 2I–
參考資料
1. Redox titration. http://en.wikipedia.org/wiki/Redox_titration
2. 維生素C之定量。http://www.ch.ntu.edu.tw/~genchem99/E-VitC.htm
3. 水中溶氧檢測方法─碘定量法。http://www.niea.gov.tw/niea/WATER/W42251C.htm


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
