形式電荷
形式電荷 (Formal Charge)
國立臺灣師範大學化學系三年級林宥辰
很多的分子和多電子離子常有不同路易士結構(Lewis structure)形式,例如硫酸根離子有一個全為單鍵的路易士結構,和多個含有雙鍵的路易士結構,然而我們應該如何決定,何種結構形式為最接近真實情況的表示呢?
其中一種方法為,利用氧化數判定,但通常我們判斷氧化數的價態分布,是把共用電子對之電子都歸類為電負度較大的原子所擁有,但事實上這樣會過度估計了價數。換句話說,雖然氧化數在氧化還原反應中很實用,但它卻在估計分子中原子的個別價數上較不恰當,所以氧化數並不適合用來判斷恰當的路易士結構。
所以,我們引入了另一種更適合判斷路易士結構之恰當性的方法──形式電荷。
首先,我們需要瞭解形式電荷不同的兩個概念:
1.分子中,中性原子的價電子數
2.分子中鍵結原子的價電子數
假如分子中的原子所擁有的價電子數,等於其在正常情形下之價電子數,則其形式電荷為0,因其正負電荷正好抵消,若其原子的價電子數多於其正常價電子數一時,則其形式電荷為-1,反之則+1,以此類推。所以我們定義形式電荷為:
形式電荷=(原子的正常價電子數)-(原子在分子中的價電子數)
為了計算分子中原子的形式電荷我們訂出了兩個假設:
1.孤對電子完全屬於該原子所擁有
2.成對電子平均分配給鍵結之原子
因此分子中原子的價電子數計算如下:
分子中原子的價電子數=(孤對電子)+ (鍵結電子對)
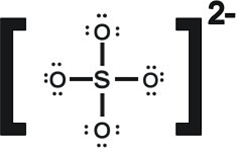
接下來我們以硫酸根分子為例,計算其不同路易士結構的形式電荷,首先硫酸根離子有32個價電子,如圖
其中每個氧原子有六個孤對電子,和一對鍵結電子,所以根據前面的式子算出其價電子為7。
再來看硫原子,其沒有孤對電子,但有四對成對電子,故其分子中原子的價電子數為4則形式電荷為2。(6-4=2)
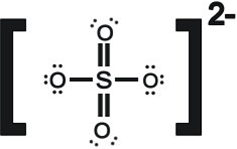
另一個硫酸根離子可能的路易士結構為如圖:
在這個例子中其形式電荷計算如下:
單鍵之氧原子:分子中原子的價電子數=6+1/2(2)=7
形式電荷=6-7=-1
雙鍵之氧原子:分子中原子的價電子數=4+1/2(4)=6
形式電荷=6-6=0
硫原子:分子中原子的價電子數=1/2×(12)=6
形式電荷=6-6=0
現在我們可以來決定,哪個路易士結構比較接近真實的分子了,其中有兩個學派分別對於此有著不同的觀點,其中一方認為原子在分子或離子中,會趨向擁有最小形式電荷者,換句話說,此學派認為電負度較大之原子的電子會略分配向帶正價數之電負度較小之原子,以利其平衡,使其各原子皆具有最小的形式電荷,由此觀點則可知擁有兩個雙鍵之硫酸根離子,較符合真實之結構。
另一學派則認為應以八隅體規則為優先,但以硫酸根為例,經實驗結果證明氧硫鍵的鍵長小於單鍵之鍵長,其真實情形較接近利用形式電荷所判斷之結果。
總結:對於形式電荷之觀念有兩點非常重要。
1.雖然形式電荷較氧化數,更接近真實分子的電子分布價數,但其終就只是估計值,不能代表真實之原子價數。
2.利用形式電荷所判定出的路易士結構,也有可能是錯誤的,其最後還是要有實驗證據佐證,形式電荷只是幫助用來預測分子或多原子離子的可能路易士結構。
參考資料
1. Zumdahl, Steven S. Chemical Principles,sixth Editio 2009 P.630-636
2. http://encyclopedia.thefreedictionary.com/formal+charge



 前一篇文章
前一篇文章 下一篇文章
下一篇文章

Good
nice
第二個硫酸根的計算
硫原子:分子中原子的價電子數=4+1/2(4)=6
錯了
應該要改為1/2*(12)=6
goodboy1556 您好
經確認後已修正,非常謝謝您的細心提醒^^
管理員Teresa敬上