尿嘧啶(Uracil)
尿嘧啶(Uracil)
國立新莊高級中學陳偉民退休教師/國立台灣師範大學化學系葉名倉教授責任編輯
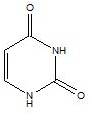
尿嘧啶(如圖1)是常見且天然存在的嘧啶衍生物。最早發現於1900年,由酵母核素(nuclein,即為核酸)水解分離而得,可存在於牛的胸腺和脾臟、腓魚的精液和小麥芽中。尿嘧啶為平面、不飽和的化合物,可吸收光線。
圖1 尿嘧啶
性質
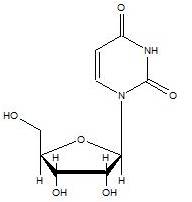
尿嘧啶存在於RNA中,與腺嘌呤形成鹼基對,在DNA轉錄反應中,取代胸嘧啶。尿嘧啶甲基化後,產生胸嘧啶,以保護DNA,並提高DNA複製之效率。尿嘧啶以氫鍵與腺嘌呤配對,因為它含有氧和氮等電負度大的原子,是氫鍵接受者,而且可形成兩個氫鍵。尿嘧啶也可以與核糖結合,形成核糖核苷──尿苷(如圖2)。若有一個磷酸根連接在尿苷上,就形成尿苷5’-單磷酸。
圖2 尿苷的化學結構
合成
在2009出版的某學術文件中,NASA的科學家報告了某種合成尿嘧啶的方法:在與太空相似的條件下,使嘧啶曝曬紫外光,可製造尿嘧啶。此研究顯示最早自然發生的尿嘧啶之可能來源。
尿嘧啶有許多實用的實驗室合成法。最簡單的合成法就是把水與胞嘧啶混合,可以產生尿嘧啶與氨。
C4H5N3O + H2O → C4H4N2O2 + NH3
合成尿嘧啶最普遍的方法就是順丁烯二酸與尿素,在發煙硫酸中進行縮合反應。
C4H4O4 + CH4N2O → C4H4N2O2 + 2 H2O + CO
硫尿嘧啶在氯乙酸水溶液中進行複分解,也是合成尿嘧啶的方法之一。此外,先用β-丙胺酸與尿素反應,可製造5,6-二氫尿嘧啶(5,6-diuracil,尿密啶的5,6兩個碳原子各多接了一個氫原子);再讓5,6-二氫尿嘧啶進行光脫氫反應,可合成尿嘧啶(如圖3)。
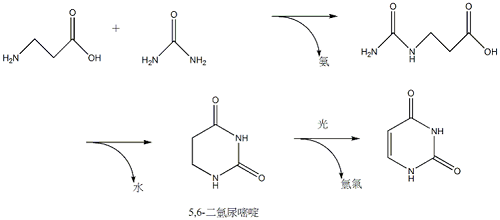
圖3 利用β-丙胺酸與尿素合成尿嘧啶
反應
尿嘧啶很容易進行一些普通的反應,包括氧化、硝化及烷基化。當有PhOH/NaOCl存在時,在UV光的藍光區,可以看見尿嘧啶。因為有一個以上提供電子的原子團,尿嘧啶也有能力與元素態鹵素反應。
尿嘧啶很容易與核糖、磷酸根進行加成反應,以便參與體內的合成及進一步反應。尿嘧啶變成尿苷、尿苷單磷酸(UMP)、尿苷二磷酸(UDP)、尿苷三磷酸(UTP)及尿苷二磷酸葡萄糖(UDP-葡萄糖)。上述每種分子都在體內合成,並各自具有專一的功能。
尿嘧啶與核糖、磷酸根鍵結可協助合成許多細胞運作必需的酶,這就是尿嘧啶在體內的用途。 尿嘧啶可作為異位(allosteric)調節劑,以及人體與植物中化學反應的輔酶。UMP控制植物的胺甲醯磷酸合成酶(carbamoyl phosphate synthetase)和天冬胺酸轉胺甲醯酶,而UDP及UTP調節動物的CPSaseⅡ(胺甲醯磷酸合成酶Ⅱ)。UDP-葡萄糖利用醣代謝反應將肝臟及其他組織中的葡萄糖轉化成半乳糖。尿嘧啶也參與多醣類的生物合成與醛糖的運輸。
用途
尿嘧啶可以用於藥物傳遞(drug delivery)及作為藥劑。元素態的氟與尿嘧啶反應,生成5-氟尿嘧啶。5-氟尿嘧啶是抗癌藥(抗代謝藥),在複製胺基酸的過程中,5-氟尿嘧啶可冒充尿嘧啶。因為5-氟尿嘧啶的形狀與尿嘧啶很相似,但化學性質不同,這種藥可以抑制RNA複製酶,因而減緩RNA合成,並使癌細胞的成長停止。
參考資料:
1. http://en.wikipedia.org/wiki/Uracil
2. http://en.wikipedia.org/wiki/Drug_delivery
3. http://en.wikipedia.org/wiki/Carbamoyl_phosphate_synthetase
4. http://uracil.navajo.cz/


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
